8. Proteínas
Objetivos
- Analizar la importancia de las proteínas en la naturaleza.
- Reconocer la estructura y las principales características de los aminoácidos.
- Comprender la importancia de la ingesta de proteínas en la dieta.
- Comprender cómo pueden ser utilizadas diferentes proteínas en la industria.
8.1. Introducción
Las proteínas son los últimos macronutrientes que estudiaremos; al igual que los hidratos de carbono y lípidos, estas son incorporadas en la dieta como fuente energética. Son moléculas poliméricas de gran tamaño, constituidas por muchas unidades estructurales, llamadas aminoácidos, que forman largas cadenas y les confieren sus propiedades características.
Se pueden clasificar en dos grandes categorías: proteínas globulares y proteínas fibrosas, dependiendo de la estructura tridimensional que adopten en el espacio.
Poseen una importante función estructural y biológica. Forman parte de los músculos, órganos y glándulas, y cumplen funciones catalíticas, hormonales, de transporte, de defensa y de reconocimiento celular, entre otras. La diversidad de las funciones permite que las proteínas posean una gran aplicación industrial alimenticia, farmacéutica, cosmética, papelera y textil.
8.2. Clasificación de los aminoácidos
Para entender las propiedades características de las proteínas es fundamental conocer la estructura de sus bloques formadores. Los aminoácidos están constituidos por un ácido débil, el carboxilo terminal (-COOH), y una base débil, la amina terminal (-NH2), y cada monómero se diferencia del otro por el grupo (-R). Este grupo puede variar desde un simple hidrógeno hasta cadenas hidrocarbonadas con oxígeno, nitrógeno y/o azufre (G.8.1).
Dependiendo de la composición del grupo R, encontramos aminoácidos neutros, ácidos, básicos, azufrados y aromáticos. Sus estructuras son ópticamente activas, es decir, que pueden rotar el plano de luz polarizada en diferente dirección dependiendo del estereoisómero de que se trate: los que rotan el plano hacia la izquierda son levorrotatorios, levógiros o L y los que lo hacen hacia la derecha, dextrorrotatorios, dextrógiros o D. En la naturaleza encontramos una mezcla de ambos que se denomina racémica, pero los aminoácidos que forman las proteínas son, la gran mayoría, L.
Estructura general de un aminoácido
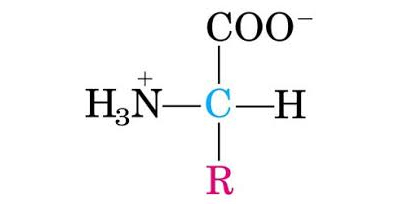
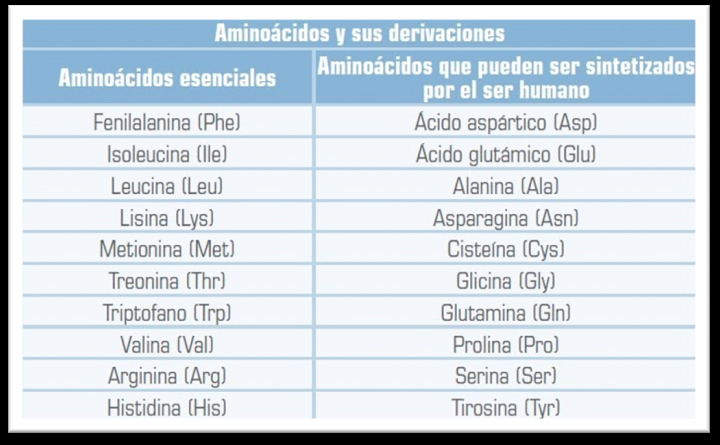
Los aminoácidos pueden definirse, desde el punto de vista nutricional, en esenciales, semiesenciales y no esenciales. El cuerpo humano necesita cerca de veinte aminoácidos para la síntesis de sus proteínas y solo puede elaborar diez. El resto de los aminoácidos, como puede observarse en el grafico G.8.2 son llamados esenciales o semiesenciales, porque solamente se obtienen de los alimentos, y el organismo humano no puede sintetizarlos o lo hace a velocidades muy bajas. Todos los aminoácidos, esenciales y no esenciales, participan en la síntesis general de proteínas y ácidos nucleicos, pero tienen además funciones específicas. Las necesidades de aminoácidos esenciales (al igual que la de proteínas) disminuyen con la edad.
Aminoácidos esenciales y no esenciales
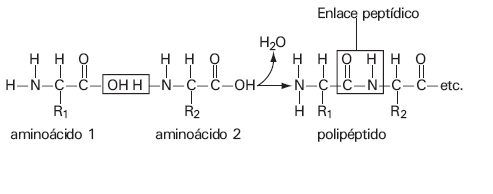
Los aminoácidos se unen entre sí a través de enlaces peptídicos, que son enlaces covalentes entre el grupo –COOH de un aminoácido y el grupo –NH2 de otro. De esta forma, se van enlazando entre sí formando cadenas de longitud y secuencia variable, denominadas polipéptidos.
Enlace peptídico
En este recurso audiovisual se explica y muestra en forma sencilla el enlace peptídico y se representan los niveles estructurales de las proteínas y las fuerzas que los estabilizan.
“Animación estructura de las proteínas” (en español, duración: 4:38 min.).
- Explique la importancia de los aminoácidos en la industria cosmética y farmacéutica.
- Determine qué alimentos debemos consumir para asegurar la incorporación de aminoácidos esenciales en la dieta.
8.3. Estructura y clasificación de las proteínas
Las cadenas peptídicas adoptan formas complejas en el espacio, que pueden organizarse en cuatro niveles conocidos como estructuras primaria, secundaria, terciaria y cuaternaria. Estas estructuras se estabilizan por diferentes interacciones intermoleculares, tales como puentes disulfuro, puentes de hidrógeno, interacciones electrostáticas, interacciones hidrófobas y fuerzas de Van der Waals. En G.8.4 se expone un descripción breve de los niveles estructurales.
Niveles estructurales de las proteínas
| Estructura de proteínas | ||
| Estructura primaria | Corresponde a la secuencia de aminoácidos determinada por el número, el orden y la identidad de los aminoácidos que constituyen la cadena polipeptídica. Las cadenas no presentan ramificaciones porque la unión peptídica solo permite formar estructuras lineales. |  |
| Estructura secundaria | Es la disposición regular y repetitiva que adopta la cadena polipeptídica en el espacio. Este plegamiento se mantiene gracias a la formación de puentes de hidrógeno. Los tipos básicos de la estructura secundaria son: Hélice \(\alpha \): las cadenas de aminoácidos tienen varios centros polares y, debido a esto, se enrolla dando lugar a una hélice que se estabiliza formando puentes de hidrógeno. Lámina \(\beta \): las cadenas de péptidos se unen formando filas paralelas que se estabilizan de manera intermolecular mediante puentes de hidrógeno. | 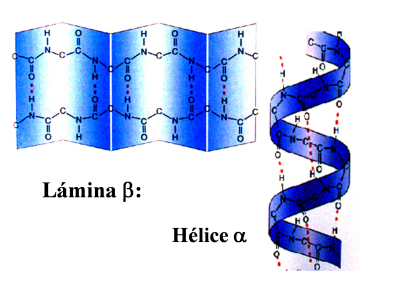 |
| Estructura terciaria | Constituye un conjunto de plegamientos que se originan por la unión entre determinadas zonas de la cadena polipeptídica. Estas uniones se realizan por medio de enlaces entre las cadenas de los aminoácidos y se deben a las fuerzas de atracción o repulsión electrostática, a enlaces de hidrógeno, a fuerzas de Van der Walls y a puentes disulfuro. | 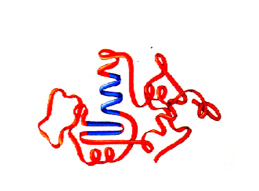 |
| Estructura cuaternaria | Estructura que contiene varias cadenas separadas pero entrelazadas en estructura terciaria. Se aplica solo a proteínas constituidas por dos o más cadenas polipeptídicas y se refiere a la disposición espacial de esas cadenas y a los enlaces que se establecen entre ellas (puentes de hidrógeno, atracciones electrostáticas, interacciones hidrofóbicas, puentes disulfuro entre cisteínas de cadenas diferentes, etcétera). | 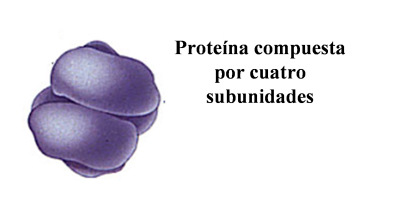 |
Las proteínas pueden diferenciarse en globulares y fibrosas. Las proteínas fibrosas son cadenas polipeptídicas ordenadas a lo largo de un eje en forma paralela, formando fibras o láminas largas. Son resistentes, insolubles en agua y constituyen elementos estructurales. Como ejemplo de este tipo de proteínas pueden nombrarse el colágeno, la elastina, la queratina y las proteínas del músculo (actina y miosina).
Las globulares son cadenas polipeptídicas plegadas sobre sí mismas y adoptan formas esféricas o globulares compactas. Son solubles en agua y poseen funciones biológicas importantes para el funcionamiento metabólico. Entre las proteínas globulares más conocidas están las enzimas, la hemoglobina, las inmunoglobulinas (IgA, IgD, IgE, IgG e IgM), y las alfa, beta y gamma globulinas. Como podemos observar, la secuencia de aminoácidos de una proteína es la que determina su conformación tridimensional y, consecuentemente, su función biológica.
Subproductos de la industria cárnica: harina de huesos y el mal de la vaca loca
El problema sanitario más importante relacionado con el uso de subproductos de origen animal en la industria alimentaria humana y animal es la Encefalopatía Espongiforme Bovina (EEB), conocido como ‘mal de la vaca loca’. En el año 1988 se identificaron las harinas preparadas a partir de huesos de rumiantes como el factor de riesgo común. El componente mayoritario de la harina de huesos provenientes de los mataderos es el colágeno que forman los cartílagos.
La EEB es una enfermedad mortal, neurodegenerativa, que pertenece al grupo de las encefalopatías transmisibles, afecta tanto a los animales como al hombre y tiene largos períodos de incubación (cinco años aproximadamente). Son transmitidas por el prión, que es una partícula proteica con características físicoquímicas y biológicas particulares. Esta molécula resiste elevadas temperaturas y tratamientos químicos, por lo que resulta muy difícil inactivarla durante los procesos productivos, especialmente en aquellos en los cuales interesa conservar la calidad nutricional el producto.
La ruta de contagio más probable es el contacto de los materiales bovinos infectados con heridas y lesiones abiertas de la piel, salpicaduras en las membranas mucosas (ojos y boca) o excepcionalmente por deglución. Por lo tanto, las actividades con riesgo potencial de contagio son aquellas en que el agente infectivo pudiera alcanzar al trabajador por alguna de las vías mencionadas al manipular, de una forma o de otra, tejidos u órganos contaminados procedentes de animales, como la harina de hueso de animales enfermos.
Actualmente, no se implementan análisis de laboratorios confiables y aplicables para la detección del prión en la industria, la única forma de controlar la propagación de la enfermedad y el riesgo de contagio de los trabajadores es a través del cumplimiento de normas de seguridad estrictas.
Tal como se ha mencionado, la manipulación y/o contacto con los triturados o harinas de carnes y huesos procedentes constituye un riesgo potencial, ya que, aunque este proceso se realiza a temperatura elevada, el agente de transmisión es termo resistente y puede no ser inactivado totalmente, quedando una potencial fuente de contaminación residual en el triturado o harina resultante.
Fuente: NTP 613. Ministerio de Trabajo y Asuntos Sociales, España.
8.4. Propiedades de las proteínas
La estructura química de las proteínas, y su capacidad de adoptar una estructura tridimensional característica, otorga a estas moléculas las propiedades que se describen a continuación.
8.4.1. Especificidad
La conformación espacial que toma cada proteína en el espacio le confiere una especificidad única. Cada molécula realiza una determinada función, y un pequeño cambio en la secuencia de aminoácidos puede provocar la pérdida de la función. Esta propiedad es fundamental para la actividad catalítica de estas moléculas y su aplicación industrial en reemplazo de los procesos químicos tradicionales.
Las enzimas y el desarrollo de la “química verde”
El desarrollo de la industria química permitió la disponibilidad de bienes de consumo y de avances tecnológicos. Sin embargo, en su etapa temprana, la sustentabilidad y el cuidado del medioambiente no fueron incluidos en la ecuación del progreso, permitiendo la generación de subproductos y compuestos tóxicos.
Los procesos químicos incluyen el empleo de catalizadores químicos que implican condiciones extremas de presión y temperaturas que provocan transformaciones progresivas del material para obtener el producto deseado. En este proceso secuencial se forman, además, una serie de productos intermedios o subproductos que pueden ser tóxicos y de difícil tratamiento. En este marco surge una nueva y revolucionaria forma de enfocar la síntesis de nuevas sustancias conocida como ‘química verde’, que propone el empleo de enzimas como sustitutos de estos procesos.
Las enzimas son proteínas globulares que actúan como catalizadores biológicos; estas moléculas están ampliamente distribuidas en la naturaleza y están presentes en todas las reacciones metabólicas. Poseen una acción catalítica, disminuyen la energía de activación necesaria para que un proceso ocurra, permitiendo que este se lleve a cabo en una escala de tiempo menor. De esta forma, aceleran las reacciones, en condiciones normales de presión y temperatura. Las enzimas son proteínas y su cadena polipeptídica adopta una conformación espacial única que las hace sumamente específicas, mostrando una selectividad en el sustrato y originando un único producto sin compuestos secundarios.
Los avances científicos demostraron que estos catalizadores también se pueden utilizar para acelerar reacciones químicas fuera de su ámbito biológico. Actualmente, los avances en tecnología enzimática permitieron diseñar técnicas específicas y procesos cada vez más sofisticados que evitan la pérdida y desnaturalización de los catalizadores biológicos, convirtiendo a la química verde en una tendencia mundial.
-
Investigue más sobre los principios de la química verde y el empleo de la tecnología enzimática en páginas relacionadas. Sugerimos las siguientes páginas para iniciar su trabajo:
<http://www2.epa.gov/green-chemistry>
<http://www2.epa.gov/sites/production/files/documents/green-chemistry-bookmark_1.pdf>
- Realice un breve informe sobre la importancia del empleo de enzimas en la industria.
8.4.2. Desnaturalización
La desnaturalización de una proteína se produce cuando se rompen los enlaces que mantienen la configuración espacial de la molécula, alterando las estructuras secundaria, terciaria y cuaternaria. Esto significa que afecta a los enlaces peptídicos: deja la secuencia de la cadena intacta, pero se ven afectados los puentes disulfuro, los puentes de hidrógeno y las interacciones débiles que suceden entre las cadenas –R de los aminoácidos.
La desnaturalización se puede producir por cambios de temperatura, variaciones del pH y alteraciones en la concentración salina del medio. Algunas veces se produce la renaturalización cuando, al volver a las condiciones normales, la proteína recupera la conformación primitiva.
La desnaturalización puede ser irreversible, si la proteína desnaturalizada no puede recuperar su conformación nativa y, por lo tanto, su función. O reversible, cuando puede recuperar su conformación nativa y funcionalidad.
8.4.3. Capacidad amortiguadora
Las proteínas, como los aminoácidos que las componen, pueden comportarse como ácidos (liberando protones) o como bases (captando protones).
- Si se compara la consistencia de un huevo antes y después de cocinarlo se observa que la clara, un producto gelatinoso y transparente, se transforma en otro de mayor consistencia y opaco a la luz. Investigue por qué se produce este cambio.
- ¿Se mantienen las propiedades nutritivas de la clara del huevo después de la cocción? Explique.

