2. Hidrocarburos
Objetivos
- Comprender la importancia de adoptar una nomenclatura universal para reconocer los hidrocarburos.
- Aplicar la metodología de la nomenclatura IUPAC de compuestos orgánicos.
- Reconocer los diferentes hidrocarburos presentes en la naturaleza.
- Diferenciar isómeros de un mismo compuesto.
- Utilizar las diferentes herramientas para la representación de los compuestos orgánicos.
2.1. Qué son los hidrocarburos
Como vimos en la unidad anterior Los hidrocarburos son los compuestos orgánicos más sencillos. Están formados únicamente por átomos de carbono y de hidrógeno. Los átomos de carbono se unen entre sí mediante enlaces que pueden ser simples, dobles o triples. Como el átomo de carbono tiene 4 electrones de valencia, el octeto queda completo con átomos de hidrógeno (que solamente pueden formar enlaces simples). Algunos hidrocarburos tienen cadena lineal, otros tienen cadena ramificada y otros son cíclicos. Las propiedades físicas y químicas dependen en gran medida de la cantidad de átomos de carbono, de la forma de molécula y de la presencia o no de enlaces dobles y triples.
Teniendo en cuenta la extensa cantidad de compuestos y la variedad de idiomas existentes, establecer una nomenclatura de las moléculas orgánicas presentes en la naturaleza es una tarea dificultosa. Hasta fines del siglo XIX se utilizaban nombres relacionados a su descubridor, origen, propiedades características (sabor, color, acción fisiológica), o las distintas formas en que se presentan las moléculas. Sin embargo, surgió la necesidad de establecer una nomenclatura sistemática y universal que describa la estructura de los compuestos orgánicos. Actualmente, en muchos casos, ambas denominaciones conviven dando lugar a los siguientes sistemas de nomenclatura:
- Nombres triviales o comunes que expresan alguna propiedad característica o se refieren al material del cual se extrajo el compuesto.
- Nombres racionales relacionados a su constitución química.
El sistema actual de nomenclatura representa en forma clara la estructura de los compuestos orgánicos. Las bases de este sistema fueron establecidas por una comisión internacional en Ginebra, en 1892, y luego perfeccionadas y ampliadas por el Comité de Nomenclatura de la Unión Internacional de Química Pura y Aplicada, por lo que se conoce como sistema IUPAC (International Union of Pure and AppliedChemistry).
Representación de moléculas en química orgánica
Existen distintas formas de representar a las moléculas, algunas más simples, otras más complejas. Estos son algunos ejemplos:
Fórmula molecular: es la más sencilla. Indica la cantidad de átomos de cada tipo en la molécula:
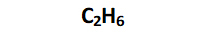
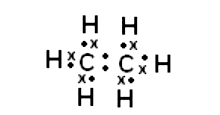
Estructura de Lewis: representa mediante un punto o cruz cada electrón de valencia:
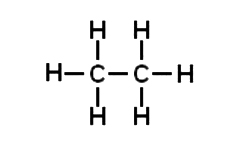
Estructura desarrollada: se representan todos los enlaces entre los átomos.
Estructura semidesarrollada: solo se representan los enlaces entre los átomos de carbono. Los átomos de hidrógeno se escriben en forma condensada
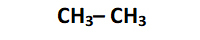
Estructura esqueletal: es una forma más simplificada que la semidesarrollada. No se representan los símbolos de los átomos de hidrógeno ni de carbono. Cada vértice o extremo corresponde a un átomo de carbono. Es una forma de representación muy utilizada en moléculas con muchos átomos.
2.2. Hidrocarburos alifáticos
Los hidrocarburos alifáticos son compuestos orgánicos que están formados por carbono e hidrógeno y cuyo carácter no es aromático. Son utilizados en la industria como disolventes para aceites, grasas, resinas, caucho y otras sustancias. Según sea el tipo de enlace de los hidrocarburos alifáticos de cadena abierta tendremos a los alcanos, alquenos y alquinos.
2.2.1. Alcanos
Son los hidrocarburos más sencillos y todos los enlaces son simples. En estas moléculas, cada átomo de carbono presenta cuatro enlaces simples con otros átomos de carbono y/o con átomos de hidrógeno. Los primeros cuatro hidrocarburos saturados de la serie homóloga tienen un nombre sistemático que consiste en utilizar los prefijos met-, et-, prop- y but- seguidos del sufijo “-ano”. De esta forma, iniciamos la lista con metano (\(CH_4\)), etano (\(CH_3-CH_3\)), propano (\(CH_3-CH_2-CH_3\)) y butano (\(CH_3-CH_2-CH_2-CH_3\)). Los hidrocarburos que poseen más de 4 átomos de carbono utilizan como raíces los numerales griegos o latinos que indican el número de átomos de carbono y la terminación "-ano", por ejemplo, el decano tiene 10 átomos de carbono. Así, todos los alcanos tienen sufijo “-ano”, y el prefijo denota la cantidad de átomos de carbono en la cadena (G.2.1).
|
Cantidad de átomos de carbono |
Prefijo |
|---|---|
| 1 |
Met- |
| 2 |
Et- |
| 3 |
Prop- |
| 4 |
But- |
| 5 |
Pent- |
| 6 |
Hex- |
| 7 |
Hept-
|
| 8 |
Oct-
|
| 9 |
Non- |
| 10 |
Dec- |
|
Tipo de compuesto |
Sufijo |
|---|---|
|
Alcano |
-ano |
|
Alqueno |
-eno |
|
Alquino |
-ino |
|
Ramificación |
-il |
En G.2.2 podemos observar la nomenclatura de los primeros alcanos de la serie homóloga. La serie homóloga es el conjunto de compuestos en los cuales cada uno difiere del siguiente en un grupo metileno CH2, excepto en los dos primeros.
|
Nombre |
Fórmula molecular |
Fórmula semidesarrollada |
|---|---|---|
|
Metano |
\(CH_4\) |
\(CH_4\) |
|
Etano |
\(C_2H_6\) |
\(CH_3-CH_3\) |
|
Propano |
\(C_3H_8\) |
\(CH_3-CH_2-CH_3\) |
|
Butano |
\(C_4H_{10}\) |
\(CH_3-CH_2-CH_2-CH_3\) |
En los hidrocarburos, las cadenas carbonadas no siempre son lineales, sino que a veces tienen ramificaciones. Estas se llaman grupos alquilo, y se nombran utilizando el mismo prefijo que en los alcanos, pero reemplazando el sufijo por -il.
Para nombrar a los alcanos ramificados hay que seguir las siguientes reglas:
- Identificar la cadena principal, que es aquella cadena lineal más larga.
- Numerar los carbonos de la cadena principal de forma tal que el carbono 1 sea el carbono extremo más próximo a una ramificación.
- Identificar y nombrar a los grupos alquilo indicando su posición en la cadena principal. Si hay más de una ramificación del mismo tipo, se agrupan anteponiendo a su nombre el prefijo di-, tri-, etc., según la cantidad de ramificaciones iguales que haya.
- Nombrar la cadena principal.
Para comprender estas reglas veremos un ejemplo en el gráfico G.2.3
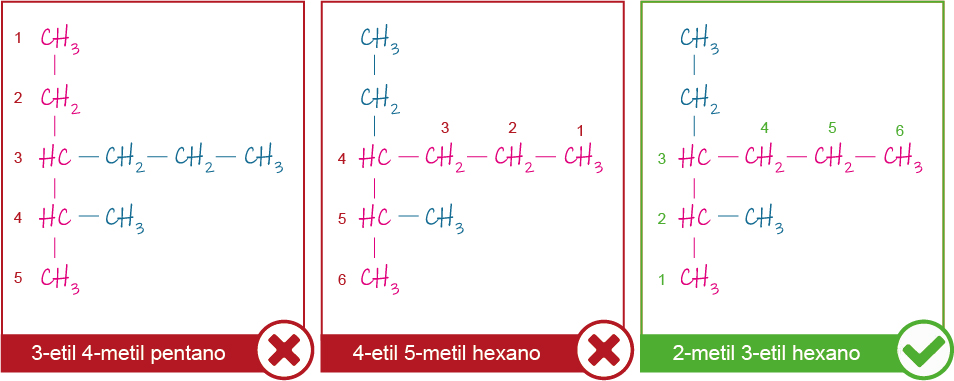
Fuente: Elaboración propia.
1. Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente los siguientes compuestos:
- 2-etil pentano
- 2,3 dimetil propano
- 5-propil hexano
- 2-etil 3-metil butano
2.2.2. Alquenos
Los alquenos se diferencian de los alcanos porque uno de sus enlaces carbono-carbono es un enlace doble, es decir, son hidrocarburos insaturados. Los alquenos lineales se nombran de la misma manera que los alcanos, pero reemplazando el sufijo -ano, por -eno. Además, se debe indicar en el nombre cuál es la posición del doble enlace en la cadena. En los alquenos, el carbono 1 es el carbono extremo más cercano al doble enlace.
Por ejemplo, en el caso del buteno, encontramos que hay dos moléculas lineales diferentes:
\(CH_2=CH-CH_2-CH_3 \) 1-buteno
\(CH_3-CH=CH-CH_3 \) 2-buteno
Estas dos moléculas, que tienen estructuras semidesarrolladas diferentes, también presentan distintas propiedades físicas y químicas.
Cabe aclarar, que la molécula 3-buteno no existe, ya que es igual a la molécula 1-buteno, mirándola al revés:
\(CH_3-CH_2-CH=CH_2\)
Las reglas para nombrar a los alquenos ramificados también son similares a las de los alcanos, pero en estos compuestos se deben tener dos consideraciones adicionales:
- La cadena principal debe ser la más larga posible y debe incluir el doble enlace.
- El carbono 1 será el carbono extremo más cercano al doble enlace (en caso de que el doble enlace esté justo en la mitad de la molécula, el carbono 1 será el extremo más cercano a una ramificación).
Veamos un ejemplo en el gráfico G.2.4.
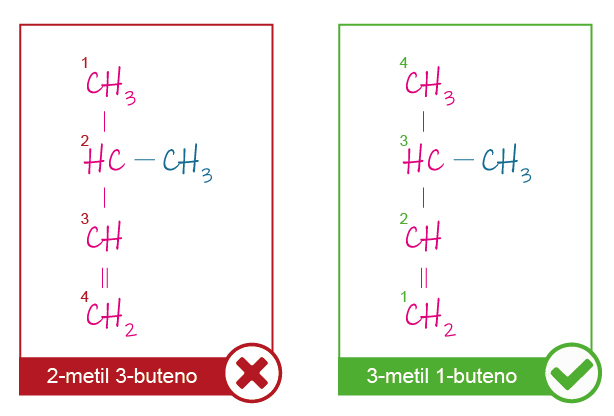
Fuente: Elaboración propia.
Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente los siguientes compuestos:
- 2- etil 3-buteno
- 3-butil 1-penteno
- 2,2- dimetil 4- hexeno
- 1-metil, 2-etil 2-propeno
Teniendo en cuenta que la seguridad e higiene se encarga de proteger la salud de los trabajadores, de manera tal que se puedan prevenir los accidentes y enfermedades relacionadas con la actividad laboral, resulta imprescindible introducirnos en los riesgos que conlleva el contacto con algunos de los compuestos alifáticos. Estos conocimientos nos permiten optimizar el trabajo del personal y a su vez reducir los riesgos en el ambiente laboral.
Ejemplos de riesgos para la salud de los alcanos
El metano y el etano pertenecen a un grupo de gases llamado “asfixiantes simples”, son farmacológicamente “inertes” y pueden ser tolerados en altas concentraciones en el aire sin producir efectos sistémicos. Sin embargo, cuando la concentración es lo bastante alta como para desplazar el oxígeno presente en el aire, producen ausencia de oxígeno y asfixia.
El metano es difícil de detectar porque es inodoro. Su baja densidad hace que tienda a acumularse en zonas mal ventiladas, donde produce una atmósfera asfixiante. El etano, a concentraciones inferiores a 50.000 ppm (5%) en la atmósfera, no produce efectos sistémicos por inhalación.
Los hidrocarburos superiores al etano pueden considerarse anestésicos generales o depresores del sistema nervioso central. Sus vapores producen una ligera irritación de las mucosas. La intensidad de la irritación aumenta de pentano a octano. En general, la toxicidad de los alcanos aumenta al hacerlo el número de carbonos de la molécula. Asimismo, los alcanos de cadena lineal son más tóxicos que los isómeros ramificados.
Los hidrocarburos parafínicos líquidos son disolventes de grasas e irritantes primarios de la piel, provocan irritación y dermatitis. La aspiración de los hidrocarburos líquidos y su contacto con el tejido pulmonar produce neumonitis química, edema pulmonar y hemorragia.
Ejemplos de riesgos para la salud de los alquenos
Como sus homólogos saturados, los hidrocarburos alifáticos insaturados inferiores u olefinas son asfixiantes simples, pero a medida que aumenta el peso molecular, las propiedades narcóticas e irritantes son mayores que las de sus análogos saturados. Por ejemplo, el etileno y el propileno se han utilizado como anestésicos en cirugía, pero requieren grandes concentraciones (60%) y por ello se administran con oxígeno. El principal riesgo del etileno es el de incendio y explosión, las mezclas etileno-aire arden cuando se exponen a cualquier fuente de ignición, como chispas estáticas, de fricción o eléctricas, llamas abiertas o calor excesivo. Frecuentemente, el etileno se manipula y transporta en forma de líquido a presión y el contacto de la piel puede causar una “quemadura por frío”.
Cuando se expone a aire u oxígeno, el butadieno forma rápidamente peróxidos, que pueden experimentar combustión espontánea. A pesar de que durante muchos años la experiencia de los trabajadores expuestos a butadieno y los experimentos con seres humanos y animales parecían indicar que este compuesto es poco tóxico, estudios epidemiológicos han demostrado que el 1,3-butadieno es un probable cancerígeno humano (Grupo 2A de la Agencia Internacional para la Investigación sobre el Cáncer (IARC)). La exposición a concentraciones muy altas de gas produce efectos irritantes y anestésicos.
Fuente: Enciclopedia de salud y seguridad en el trabajo, 1998.
2.2.3. Alquinos
Los alquinos también son hidrocarburos insaturados (como los alquenos), pero en este caso la insaturación es un triple enlace. La forma de nombrar a los alquinos lineales y ramificados es igual a la de los alquenos, pero reemplazando el sufijo por -ino.
Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente los siguientes compuestos:
- 1-metil 1-propino
- 1-metil 2-propino
- 2,3-dietl 4-pentino
- 2-metil 3-butino
Fórmulas moleculares de alcanos, alquenos y alquinos alifáticos
A partir de la fórmula molecular es posible determinar si el compuesto es un alcano, un alqueno o un alquino alifático, debido a que cada tipo de compuesto tiene una proporción carbono e hidrógeno determinada:
Alcanos: \(C_nH_{2n+2}\)
Alquenos: \(C_nH_{2n}\)
Alquinos: \(C_nH_{2n-2}\)
Donde \(n\) es la cantidad de átomos de carbono.
Por ejemplo, para un alcano de 20 átomos de carbono, la fórmula será \(C_{20}H_{42}\), para un alqueno de la misma cantidad de carbonos será \(C_{20}H_{40}\) y para un alquino será \(C_{20}H_{38}\)
Alcanos, Alquenos y Alquinos. Video explicativo de la química orgánica con la formulación de hidrocarburos y cómo representarlos y nombrarlos. (Duración 13:50)
2.3. Hidrocarburos cíclicos
Si la cadena alifática se cierra formando un anillo, sin ser derivados del benceno, el compuesto se denomina alifático cíclico como, por ejemplo, los cicloalcanos, cicloalquenos y cicloalquinos. Estos pueden ser no saturados, en los casos de las cadenas unidas con dobles o triples enlaces, o saturados, cuando todos los enlaces son simples.
2.3.1. Cicloalcanos
Los alcanos cíclicos derivan de los lineales a partir de la unión de sus átomos de carbono con la consecuente formación de un ciclo o anillo. El nombre de los alcanos cíclicos surge añadiendo el prefijo ciclo- al nombre del alcano lineal con el mismo número de átomos de carbono.
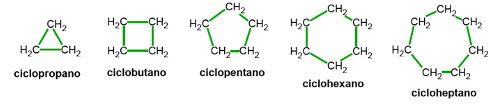
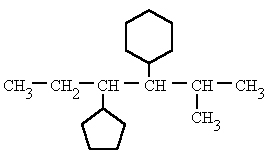
Cuando el cicloalcano está monosustituido todas las posiciones son equivalentes y no es necesario indicar la posición del único sustituyente. Sin embargo, si existen dos o más ramificaciones se numera el anillo de forma tal que se le asigne el número 1 al sustituyente con mayor prioridad alfabética y los números más bajos a los sustituyentes restantes.
Cuando hay más de un ciclo en una misma molécula, o cuando un único ciclo no sustituido se encuentra unido a una cadena más larga, estos se pueden nombrar como grupos alquilo. Si existen sustituyentes iguales, se añaden los prefijos correspondientes (di-, tri-, tetra-).

2.3.2. Cicloalquenos
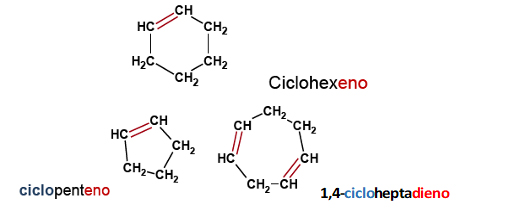
Los alquenos cíclicos siguen las mismas reglas de nomenclatura que los alcanos cíclicos, y se nombran añadiendo el prefijo ciclo- al nombre del alqueno equivalente de cadena abierta. Para nombrar los cicloalquenos se asignan como 1 y 2 a los carbonos del doble enlace; el doble enlace siempre está en posición 1 por lo que no es necesario especificarlo en el nombre del compuesto.
Si existen dos o más dobles enlaces, se numera el anillo de tal forma que se le asigne el número más bajo a los dobles enlaces. Si existen sustituyentes o grupos alquilo, el anillo se numera de tal forma que se le asignen los números más bajos a los sustituyentes.
Escriba la fórmula semidesarrollada de los siguientes compuestos:
- Metilciclohexano
- 3-metilciclohexeno
- 1,3 ciclooctadieno
- 2-pentil hexano
2.3.3. Cicloalquinos
Los cicloalquinos se nombran siguiendo las mismas reglas que los cicloalquenos, pero reemplazando el sufijo por -ino.
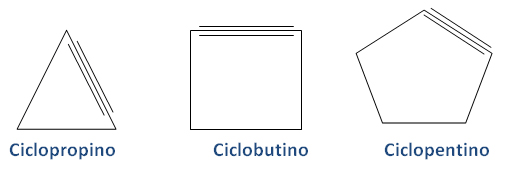
Los mecanismos de las reacciones químicas de los cicloalquinos son muy complejas. En términos generales, son muy reactivos y representan un punto de partida para la síntesis de muchos compuestos orgánicos, sus triples enlaces pueden conjugarse con dobles enlaces, creando unidades cíclicas dentro de las moléculas.
2.4. Hidrocarburos aromáticos
Son compuestos orgánicos cíclicos con dobles enlaces conjugados. El más simple de esta familia es el benceno y todos los derivados de este compuesto se consideran compuestos aromáticos. Históricamente, se los llamaba de esa manera porque muchas de estas moléculas tenían aromas distintivos.
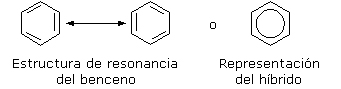
El benceno es un hidrocarburo de fórmula \(C_6H_6\). La molécula tiene geometría hexagonal plana y puede describirse mediante dos estructuras resonantes con dobles enlaces conjugados. Sin embargo, dentro del anillo no existen en realidad simples y dobles enlaces, sino que la molécula es una mezcla simultánea de ambas estructuras, que contribuyen por igual a la estructura electrónica. Es por tal motivo que se suele representar a la molécula con un círculo en el centro del anillo.
Dobles enlaces conjugados
Los dobles enlaces están conjugados cuando se alternan con los enlaces simples (uno doble y uno simple, sucesivamente). Además de los compuestos aromáticos, hay otras moléculas con dobles enlaces conjugados como, por ejemplo, el betacaroteno, que es el pigmento que le da el color naranja a la zanahoria.
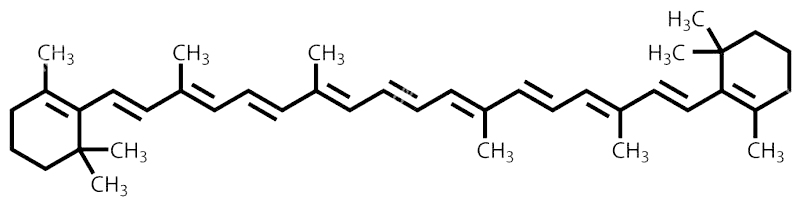
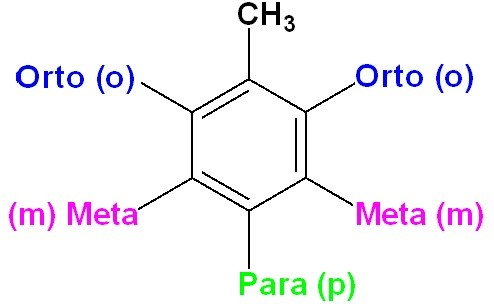
La molécula de benceno puede tener uno o más sustituyentes. Cuando solo hay un sustituyente no es necesario indicar su posición en el anillo. Por el contrario, cuando dos de las posiciones en el anillo han sido sustituidas, se pueden indicar numerando los carbonos del anillo, o utilizando los prefijos orto (o), meta (m) o para (p). El prefijo orto- indica que los sustituyentes se encuentran en una relación 1,2; meta- y para- indican relaciones 1,3 y 1,4, respectivamente. En caso de que el anillo tenga 3 o más sustituyentes, sus posiciones se indican numerando los carbonos del anillo.
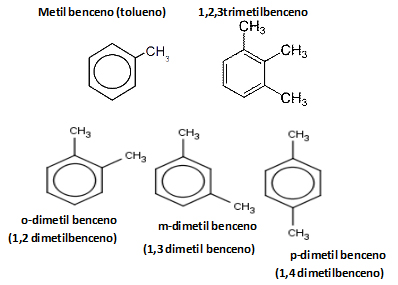
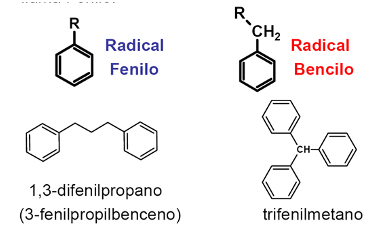
Cuando hay más de un anillo bencénico en una molécula, o cuando un único anillo no sustituido se encuentra unido a una cadena más larga, estos se pueden nombrar como grupos alquilo. Si existen sustituyentes iguales, se añaden los prefijos correspondientes (di-, tri-, tetra-).
Donde R es una cadena hidrocarbonada
El benceno es muy volátil, sus vapores son inflamables y tóxicos (con acción cancerígena) por lo que debe usarse con las debidas precauciones. Sin embargo, esto no significa que los compuestos que contienen un anillo de benceno como parte de su estructura son también cancerígenos. Por lo tanto, la presencia de un anillo de benceno en la estructura de un compuesto no es una causa automática de preocupación, de hecho, un gran número de compuestos que se encuentran en nuestros alimentos contienen un anillo de benceno en algún lugar de su estructura.
Los derivados de benceno han sido aislados y utilizados como reactivos industriales desde el inicio de la aplicación de procesos químicos, por lo tanto, muchos de los nombres de los compuestos aromáticos están arraigados en el lenguaje histórico de la química (<https://www.lifeder.com/derivados-del-benceno/>).
En el siguiente cuadro se enumeran, a modo de ejemplo, algunos compuestos aromáticos empleados en la industria, con sus nombres triviales y las principales aplicaciones.
|
Nomenclatura Histórica |
Nomenclatura IUPAC |
Uso y Aplicación |
|---|---|---|
|
fenol |
benceno |
Epoxis, resinas y películas |
|
tolueno |
metil benceno |
Disolvente aditivo de gasolinas y productos anticoagulantes Manufactura de cosméticos, productos de perfumería, fármacos |
|
anilina |
metoxi benceno |
Tinturas y productos farmacéuticos |
|
estireno |
vinil benceno |
El estireno se polimeriza para formar poliestirenos: cubiertos de plástico, envasado de alimentos, materiales de embalaje de espuma, cajas de computadoras y materiales de aislamiento |
|
benzaldehído |
benceno carbaldehído |
Saborizante alimentario comercial (sabor de almendras) o disolvente industrial |
|
ácido benzoico |
ácido benceno carboxílico |
Conservante de alimentos curado de tabaco |
- El tolueno es un hidrocarburo de tipo aromático de olor característico
que se produce a partir del benceno:
- Investigue su importancia y aplicación.
- Realice una reseña toxicológica para el tolueno.
-
Nombre los siguientes compuestos aromáticos:
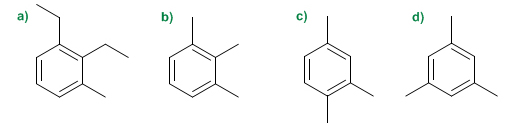
Algunas moléculas más complejas se forman por la fusión de varios anillos de benceno como, por ejemplo, el naftaleno (o naftalina), un sólido blanco que se utiliza para ahuyentar polillas.
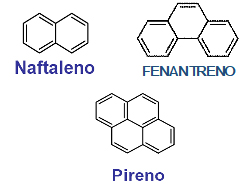
Realice un informe explicando cuáles son los efectos sobre la salud de los hidrocarburos aromáticos policíclicos (PAH), cómo se producen y qué medidas preventivas deben tomarse para evitar la exposición a estos compuestos.
2.5. Isómeros
Los isómeros son moléculas que tienen la misma fórmula molecular, pero diferente fórmula desarrollada. Debido a la diferencia en sus estructuras, los isómeros tienen diferentes propiedades físicas y químicas.
Los principales tipos de isómeros que presentan los hidrocarburos son:
- Isómeros de cadena: difieren en la posición de los átomos en la cadena que puede ser lineal o tener distintas ramificaciones.
- Isómeros de posición: los alquenos o alquinos tienen el doble o triple enlace en una posición diferente.
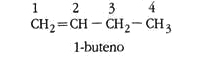
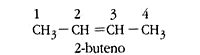
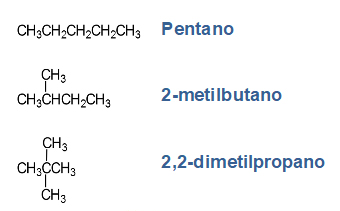
- Escriba las estructuras semidesarrolladas y nombre dos isómeros del 2,2-dimetil butano.
- El 2-metil hexano y el 5-metil hexano, ¿son isómeros? Escriba sus estructuras y justifique.
- El 2-metil 1-hexeno y el 5-metil 1-hexeno, ¿son isómeros? Escriba sus estructuras y justifique.

