4. Compuestos oxigenados
Objetivos
- Reconocer los diferentes compuestos orgánicos oxigenados.
- Aplicar la metodología de la nomenclatura IUPAC de compuestos orgánicos oxigenados.
- Comparar las propiedades físicas y químicas de los compuestos oxigenados.
4.1. Cuáles son los compuestos orgánicos oxigenados
Los compuestos orgánicos oxigenados son aquellos que contienen carbono, hidrógeno y oxígeno. Dependiendo de la unión entre estos átomos, se pueden clasificar en alcoholes, fenoles, aldehídos, cetonas, ácidos carboxílicos, éteres y ésteres. Cada tipo de compuesto tiene propiedades físicas y químicas diferentes, así como también distintas aplicaciones industriales. Muchos de ellos son de uso cotidiano, por ejemplo, el alcohol etílico, que encontramos en las bebidas alcohólicas y en el alcohol farmacéutico que se utiliza como desinfectante, o la acetona que se utiliza como quitaesmalte de uñas.
4.2. Nomenclatura general
Al igual que los hidrocarburos, los compuestos oxigenados se pueden nombrar según la nomenclatura IUPAC, aunque en algunos casos se continúa utilizando sus nombres triviales. Según la nomenclatura IUPAC, el nombre está formado por un prefijo que indica la cantidad de átomos de carbono y un sufijo que indica el tipo de compuesto (son los mismos sufijos que se utilizan en los hidrocarburos, G.4.1.). En el caso de los ácidos carboxílicos, se antepone la palabra ácido al nombre.
Sufijos de los compuestos orgánicos oxigenados

Las reglas para nombrar a los compuestos oxigenados son similares a la de los hidrocarburos, con algunas pequeñas diferencias:
- Identificar la cadena principal, que es aquella cadena lineal más larga que contiene al carbono con el grupo funcional.
- Numerar los carbonos de la cadena principal de forma tal que el carbono 1 sea el carbono extremo más próximo al grupo funcional. En caso de que el grupo funcional esté justo en la mitad de la molécula, el carbono 1 será el extremo más cercano a una ramificación.
- Identificar a los grupos alquilo (ramificaciones) indicando su posición en la cadena principal. Si hay más de una ramificación del mismo tipo, se agrupan anteponiendo a su nombre el prefijo di-, tri-, etc., según la cantidad de ramificaciones iguales que haya.
- Nombrar las ramificaciones y la cadena principal.
4.3. Alcoholes y fenoles
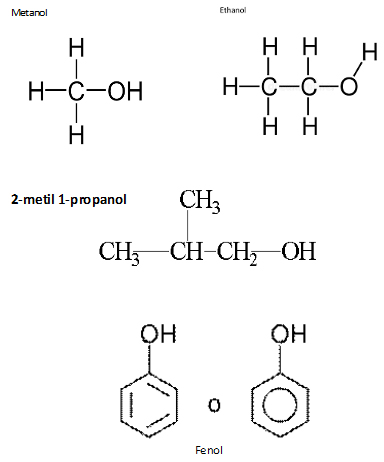
Los alcoholes tienen fórmula general R-OH, donde R es una cadena hidrocarbonada. Los fenoles tienen el mismo grupo funcional -OH pero unido a un anillo aromático.
El alcohol más utilizado en la industria es el etanol. Puede obtenerse por fermentación de azúcares, por ejemplo, en el proceso de elaboración de vino o cerveza, o a partir del petróleo. En este último caso, el alcohol que se obtiene, si bien tiene la misma estructura química que el que se produce por el proceso de fermentación, no puede ser utilizado en alimentos porque podría tener contaminantes nocivos para la salud.
Desde comienzos de la humanidad, el hombre desarrolló y adoptó procesos biológicos para elaborar y conservar alimentos y bebidas. La fermentación alcohólica es un proceso natural que realizan los microorganismos en ausencia de oxígeno (\( O_2\)) cuando utilizan los azúcares como sustrato para obtener energía en forma de ATP (Adenosín Trifosfato), originando además etanol (cuya fórmula química es \(CH_3-CH_2-OH\)) y dióxido de carbono (\(CO_2\)) en forma de gas. El etanol resultante se emplea en la elaboración de bebidas alcohólicas, como el vino, la cerveza y la sidra.
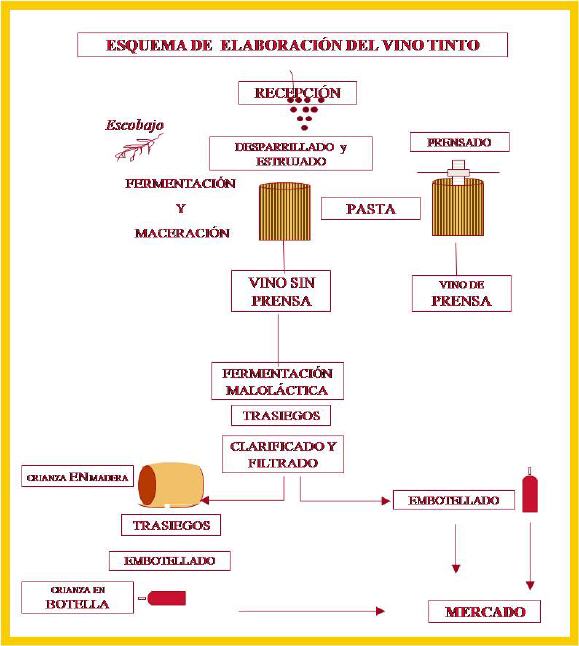
La fermentación alcohólica del vino es muy antigua y, actualmente, se ha convertido en un proceso que ha logrado estandarizarse, y se ha convertido en uno de los sectores más importantes de la industria de alimentos. Las levaduras responsables de la fermentación son microorganismos endógenos que se alojan naturalmente en el exterior de las uvas, y mayormente pertenecen a las especies de Saccharomyces cerevisiae, aunque también se emplean en el proceso industrial la S. bayanus y la S. oviformis. En el gráfico G.4.2 se muestra un diagrama de elaboración industrial de vino tinto.
Diagrama de elaboración industrial de vino tinto
Ejemplo de alcoholes y fenoles
Los seres humanos han desarrollado la capacidad para metabolizar etanol desde comienzos de la civilización; en nuestro organismo, el hígado es el responsable de eliminar el 95% de alcohol que consumimos y el resto es excretado a través del aliento, la orina, el sudor, el excremento, la leche y la saliva. Esta capacidad ha hecho posible que podamos consumir etanol en bebidas alcohólicas como el vino, la sidra, la cerveza y otras bebidas espirituosas.
El consumo de alcohol, sin embargo no puede hacerse extensivo a otros alcoholes como el metanol, aunque posea características sensoriales similares (color, aroma y sabor). Cuando una persona consume una bebida alcohólica que contiene cantidades peligrosas de metanol, ya sea por adulteración o por una destilación de baja calidad, este compuesto se transforma en ácido fórmico, que se metaboliza muy lentamente. El ácido fórmico se acumula en el organismo y finalmente alcanza niveles tóxicos. Como se mencionó en la unidad 1, los efectos iniciales del consumo de metanol son parecidos al consumo de etanol, sin embargo, entre las 10 y 30 horas posteriores aparecen los síntomas causados por los niveles tóxicos de ácido fórmico y formiatos, que incluyen visión borrosa, pérdida total de visión, acidosis y, si la dosis es elevada, muerte por fallo respiratorio. En Argentina, en 1993, dos vinos de consumo popular, “Soy Cuyano” y “Mansero”, fueron adulterados con metanol y causaron la muerte de al menos 26 personas y ceguera e invalidez a muchas otras.
- Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente
los siguientes compuestos (cuando corresponda):
- 2- metil 3-butanol
- 1,2- dimetil 5-pentanol
- 3-metilfenol.
- ¿Cuáles son los efectos sobre la salud que causa un consumo excesivo de alcohol etílico (etanol)?
- ¿Cuáles son los usos y aplicaciones del fenol? ¿Cuál es la toxicidad de este producto?
4.4. Aldehídos y cetonas
Los aldehídos y las cetonas tienen un grupo funcional carbonilo C=O. Los aldehídos son terminales, lo cual significa que el grupo carbonilo solo puede estar en el carbono 1. De forma contraria, las cetonas no pueden ser terminales (el grupo carbonilo no puede estar en el carbono 1).
Los aldehídos y cetonas pueden ser alifáticos o aromáticos. Algunos ejemplos son el formol (metanal), que se emplea en la conservación de cuerpos muertos para evitar su descomposición, y la acetona (propanona) que se utiliza como quitaesmalte de uñas.
Los aldehídos y las cetonas, si tienen la misma cantidad de átomos de carbono, son isómeros de función, ya que su fórmula molecular es la misma, pero tienen diferentes grupos funcionales.
Ejemplo de aldehídos y cetonas

- Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente
los siguientes compuestos (cuando corresponda);
- 2,3-dietil butanal
- 3- metil 4-hexanona
- O-metil benzaldehído
- Explique cuáles de los siguientes pares de compuestos son isómeros entre
sí.
- Butanal y butanona
- Butanol y butanona
- 3-metil 2-pentanona y hexanal
4.5. Ácidos carboxílicos
Los ácidos carboxílicos tienen el grupo funcional -COOH. Al igual que los aldehídos, siempre son terminales. Los ácidos carboxílicos se caracterizan por disminuir el pH cuando se disuelven en agua. Algunos ácidos carboxílicos comunes son el ácido fórmico (ácido metanoico) que secretan las hormigas, el ácido acético (ácido etanoico) presente en el vinagre o el ácido butírico (ácido butanoico) que da el olor característico a la manteca.
El pH de una solución es una medida de su acidez o basicidad. La escala de pH varía entre 0 y 14. Las sustancias ácidas tienen un pH entre 0 y 7, mientras que las básicas o alcalinas tienen un pH entre 7 y 14. Las sustancias neutras, como el agua, tienen un pH de 7.
Cuanto más fuerte es un ácido, más cercano a cero será su pH. Los ácidos inorgánicos, como el \(HCl\) o el \(HNO_3\), son ácidos más fuertes que los ácidos orgánicos. Esto significa que, para una misma concentración, el pH de los ácidos fuertes es menor (más cercano a cero) que el de los ácidos débiles.
Ejemplo de ácidos carboxílicos
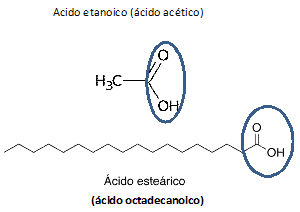
Escriba la fórmula semidesarrollada, la fórmula molecular y nombre correctamente los siguientes compuestos (cuando corresponda):
- Ácido 3- propil hexanoico
- Ácido 2-etil butanoico
- Ácido 2- etil benzoico
4.6. Éteres y ésteres
Los éteres y ésteres son compuestos oxigenados que se forman por reacción de dos alcoholes, o de un alcohol y un ácido carboxílico respectivamente. En la formación de estos compuestos se libera una molécula de agua. La mayoría de los éteres son líquidos volátiles, ligeros e inflamables, solubles en alcoholes y otros disolventes orgánicos. El éter más común es el éter etílico que se emplea como anestésico y solvente. Los ésteres, por su parte, están presentes en muchas frutas y flores, dando el olor característico. Por ejemplo, el acetato de isoamilo se encuentra en el plátano, el butirato de amilo en el damasco, y el acetato de etilo en la piña.
Ejemplo de éteres y ésteres

4.7. Compuestos con varios grupos funcionales
Muchos de los compuestos orgánicos presentan, en la misma molécula, varios grupos funcionales. Por ejemplo, los ácidos grasos insaturados son ácidos carboxílicos que tienen uno o más dobles enlaces en su cadena. Otras moléculas, como el ácido cítrico, tienen tres grupos ácidos carboxílicos; el ácido láctico tiene un grupo ácido y un grupo alcohol. Estos compuestos suelen llamarse por su nombre común o trivial, aunque también se los puede nombrar según las reglas IUPAC. Si bien no es objetivo de este curso profundizar en las reglas de nomenclatura, es importante poder reconocer estos grupos funcionales en distintas moléculas de importancia biológica o en las utilizadas en la industria.
Ejemplo de compuestos con varios grupos funcionales en su estructura

El ácido cítrico (ácido 2-hidroxi-1,2,3-propanotricarboxílico) es un ácido orgánico natural que también puede ser obtenido sintéticamente en el laboratorio. Se encuentra presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja y es considerado ingrediente versátil y ampliamente utilizado en el campo de la alimentación, de los productos farmacéuticos y cosméticos, entre otros.
En la industria alimentaria, debido a su sabor agradable, baja toxicidad y otras propiedades físicoquímicas, el ácido cítrico tiene un sinnúmero de aplicaciones. Es uno de los principales aditivos alimentarios, se utiliza como conservante, antioxidante, acidulante y saborizante de golosinas, bebidas gaseosas y otros alimentos.
Para responder a la gran demanda actual, la producción mundial de ácido cítrico se estima en millones de toneladas por año y su obtención principal radica en el empleo de fermentaciones donde el microorganismo Aspergillus niger utiliza dextrosa o melaza de caña de azúcar como materia fuente de energía.
- Busque en internet las siguientes moléculas e identifique en cada una
de ellas los grupos funcionales presentes:
- Ácido pirúvico
- Ácido láctico
- Ácido oleico
- Glucosa (estructura de Fischer o lineal)
- Fructosa (estructura de Fischer o lineal)
- Ácido málico
- A partir de las estructuras representadas, identifique cuáles de ellas son isómeros entre sí. Justificar.

