1. Introducción a la química orgánica
Objetivos
- Comprender los conceptos introductorios de química orgánica.
- Reconocer la importancia de la química del carbono, su estructura y las principales características de los compuestos orgánicos.
- Analizar la importancia y las aplicaciones de esta ciencia.
- Aplicar las herramientas presentadas en esta unidad.
1.1. ¿Qué es la química orgánica?
La química orgánica se define como la química de los compuestos que contienen carbono. Antiguamente los compuestos se dividían en inorgánicos y orgánicos, dependiendo de su origen: los compuestos inorgánicos provenían de los minerales y los orgánicos, de los seres vivos.
La mayoría de los compuestos de la materia viva están formados por carbono, hidrógeno, oxígeno y nitrógeno, y, en menor medida, por azufre y fósforo y algunos otros elementos. Es importante destacar que el carbono siempre está presente en los compuestos orgánicos, de ahí que se los denomine también como compuestos del carbono. Los elementos de los compuestos orgánicos se unen fundamentalmente mediante enlaces covalentes del tipo carbono-hidrógeno (C-H) y carbono-carbono (C-C), con algunas excepciones, como la urea, que no presenta este tipo de enlaces.
En la actualidad, el término “orgánico” no se refiere solo a los compuestos derivados de los organismos vivos, sino que incluye además compuestos que derivan del petróleo y del carbón, así como otros preparados sintéticamente en el laboratorio.
Si bien la química orgánica no cuenta con una definición estandarizada e inequívoca, podemos decir que es la disciplina que estudia la estructura, las propiedades, la síntesis y la reactividad de compuestos formados principalmente por carbono e hidrógeno. Estos compuestos pueden ser tanto de origen natural como sintético, e incluir en su estructura oxígeno, azufre, nitrógeno, fósforo y silicio.
Los compuestos orgánicos comprenden desde moléculas simples que contienen un solo átomo de carbono, como el gas metano, hasta moléculas complejas o macromoléculas, como hidratos de carbono, lípidos y proteínas.
Por último, podemos asegurar que el carbono es la base de la química orgánica. Está constituido por 6 protones, 6 electrones y, en su última capa de valencia, por 4 electrones disponibles para formar enlaces con otros elementos (\( 1s^22s^22p^2 \)). A fin de lograr una configuración estable, debe formar 4 enlaces con otros átomos, de acuerdo con la llamada regla del octeto. Esta característica le permite integrar compuestos de estructuras abiertas o cerradas, mediante enlaces covalentes que pueden ser:
-
Simples: se comparten un par de electrones.
-
Dobles: se comparten dos pares de electrones.
-
Triples: comparten tres pares de electrones.
-
Aromáticos: son “enlaces especiales”, que pueden considerarse intermedios entre los enlaces simples y dobles.
La regla del octeto, enunciada en 1916 por el científico norteamericano Gilbert Newton Lewis, postula que los iones de los elementos del sistema periódico tienden a ganar, ceder o compartir electrones para completar los 8 electrones de su últimos niveles de energía. De esta forma, adoptan la configuración más estable, semejante a la del gas noble ubicado más próximo en la tabla periódica. Es importante saber que se trata de una regla práctica aproximada que presenta numerosas excepciones, como el caso del hidrógeno, que solo puede tener 2 electrones en su última capa, pero que sirve para predecir el comportamiento de muchas sustancias.
Estructura del átomo de carbono
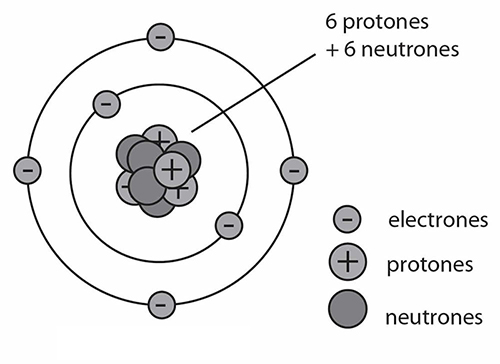
Como se mencionó anteriormente, los átomos de carbono forman enlaces covalentes para lograr una configuración estable. Además pueden unirse a otros átomos o grupos de átomos que les confieren a las moléculas resultantes propiedades específicas, obteniéndose así una amplia variedad de sustancias; estas pueden definirse de distintas maneras de acuerdo con la funcionalidad, el origen, etc. Las moléculas orgánicas incluyen: alcoholes, hidrocarburos, medicamentos, vitaminas, biomoléculas (proteínas, lípidos, carbohidratos), plásticos, fibras sintéticas y naturales.
En este video se puede ver el nacimiento de la química orgánica. Se hace un breve repaso de su surgimiento, de la relación con los estudios de Friedrich Wöhler, así como del aporte del químico Friedrich August Kekulé. Por otro lado, se muestra en forma clara y sencilla la estructura atómica de los elementos y los tipos de enlace en los que pueden intervenir teniendo en cuenta su estructura.
“Química orgánica” (1 de 6), Introducción (Canal de Video Ciencias, en español, duración: 9:09 min.).
Friedrich Wöhler (1800-1882)
Fue un químico extraordinario, el primero en aislar el aluminio, el boro, el berilio, el silicio y el titanio. Pero su mayor hallazgo –que se produjo casualmente–, consistió en la síntesis de la urea (un producto orgánico) a partir de productos inorgánicos, causando estupor en el mundo científico.
En aquel tiempo casi todos los químicos creían que era imposible sintetizar los productos generados por los seres vivos gracias a la “fuerza vital” que poseían, idea que se remontaba a Aristóteles. La síntesis de la urea en 1828 marca la fecha de la muerte de la idea filosófica del vitalismo y el comienzo de la química orgánica.
Friedrich August Kekulé (1829-1896)
Un químico soñador. La expresión “químico soñador” es realmente una tautología, es una idea redundante, pues todo químico es soñador aunque la recíproca no sea cierta. Uno de los soñadores más extraordinarios fue Friedrich August Kekulé von Stradonitz, que debe la nobleza de su “von Stradonitz” a un sueño y también al átomo de carbono. Entre los muchos trabajos de Kekulé destacan el descubrimiento de la tetravalencia del carbono y el de la estructura del benceno, producto que estaba llamado a representar un gran papel. Kekulé llevaba tiempo intentando duramente resolver el problema sin éxito, cuando lo consiguió en un sueño. El relato de Kekulé es el siguiente: “[…] mi espíritu se encontraba en otra parte. Giré mi butaca hacia la chimenea y quedé medio dormido. De nuevo los átomos bailaron ante mis ojos... y ¿qué es eso? Una serpiente agarraba su propia cola, y la forma engendrada giraba burlonamente ante mis ojos”. Esta visión le inspiró la idea del anillo bencénico y le sirvió para sentar las bases de la estructura química. Quizás no sea casual en estos hallazgos que la primera vocación de Kekulé fuera hacia la arquitectura, que cambió hacia la química por influencia de Liebig.
Como siempre hay gente simpática, un científico importante de la época se refirió despectivamente a las diversas propuestas de Kekulé llamándolas “las fórmulas de las salchichas”.
Fragmentos extraídos del libro Hitos de la Química [en línea].
1.2. Qué diferencias hay entre compuestos orgánicos e inorgánicos?
Los compuestos orgánicos y los inorgánicos presentan distintas propiedades, como la solubilidad y la estabilidad, y difieren además en el tipo de reacciones químicas en las que participan. Los procesos reactivos en los que intervienen los compuestos inorgánicos son reacciones iónicas, simples, que ocurren en forma prácticamente instantánea. Por otro lado, los compuestos orgánicos, participan de reacciones más complejas y de carácter no-iónicas. En la actualidad se conocen más de siete millones de compuestos de carbono y cada año se descubren miles de nuevos compuestos.
En G.1.2 se enumeran en forma comparativa las principales características de los compuestos orgánicos e inorgánicos.
|
Características |
Compuestos inorgánicos |
Compuestos orgánicos |
|---|---|---|
|
Enlaces |
Iónicos |
Covalentes |
|
Fuerzas |
Ion-ion (fuertes) |
Dipolo-dipolo (débil) |
|
Composición elemental |
Todos los elementos de la tabla periódica |
Carbono, hidrógeno, oxígeno, nitrógeno, azufre, fósforo y halógenos |
|
Número de compuestos |
Bajo número |
Alto número |
|
Tipo de compuestos |
Sales principalmente |
Varían en composición y función |
|
Solubilidad |
En medios acuosos |
En medios orgánicos |
|
Combustibilidad |
No arden |
Arden |
|
Conductividad |
Conducen |
No conducen |
|
Isomería |
No presentan |
Pueden presentar |
|
Polimerización |
No presentan |
Pueden presentar |
Fuente: Elaboración propia.
1.3. Importancia de la química orgánica
La química está presente en nuestra vida cotidiana, estamos formados y rodeados por compuestos orgánicos. Las proteínas, los lípidos, los hidratos de carbono y los ácidos nucleicos componen las células de todos los organismos vivos. Nuestro cuerpo se nutre, degrada y sintetiza moléculas orgánicas. Compuestos químicos conviven diariamente con nosotros, Medicamentos, analgésicos, antihistamínicos, insecticidas, conservantes, detergentes, plásticos, gomas, pegamentos, colorantes, aislantes, fórmicas y combustibles constituyen una parte esencial de nuestra vida.
Los avances científico-tecnológicos impactan directamente en el estilo de vida. La industria de la química orgánica crece en forma constante. La búsqueda de recursos renovables, la aplicación de tecnologías limpias y la elaboración de productos alimenticios son, hoy, temas prioritarios. De esta manera, el aprovechamiento de recursos, el cuidado del medioambiente y las mejoras futuras dependerán de la comprensión y aplicación de los conceptos adquiridos en esta área.
El video propuesto expone en forma clara la intervención de la química en distintos aspectos. Hace un recorrido ameno y descriptivo de ejemplos cotidianos en los que se refleja la importancia de esta ciencia. Esta actividad resulta interesante para que el alumno descubra la intervención de la química orgánica tanto en situaciones cotidianas, como en distintos sectores industriales.
“La química y la vida” (Programa Compromiso de Progreso - Responsible Care, en español, duración: 10:35 min).
1.4. Estructura de los compuestos orgánicos
Los hidrocarburos son los derivados del carbono más sencillos. Resultan de la unión entre átomos de carbono y entre átomos de carbono y átomos de hidrógeno. Forman cadenas abiertas o cerradas, cuyos “eslabones” pueden estar unidos por enlaces simples o por enlaces múltiples. De acuerdo con sus esqueletos carbonados, podemos denominar a las cadenas abiertas como lineales y a las cerradas como cíclicas.
Estos hidrocarburos compuestos exclusivamente por carbono e hidrógeno pueden dividirse en:
-
Compuestos saturados, que presentan únicamente enlaces simples (alcanos).
-
Compuestos no saturados, que se caracterizan, desde el punto de vista de su estructura molecular, por la presencia de enlaces dobles (alquenos) o triples (alquinos).
Los hidrocarburos saturados de cadena abierta constituyen el grupo de los alcanos o parafinas. La composición de todos los miembros del grupo responde a la fórmula \( C_n H_{2n+2} \) , donde \( n \) es el número de átomos de carbono de la molécula. Tienen la característica de ser inertes, es decir que no reaccionan fácilmente, en condiciones normales de presión y temperatura, con reactivos como los ácidos, los álcalis o los oxidantes.
El grupo de los alquenos u olefinas está formado por hidrocarburos de cadena abierta en los que existe un doble enlace entre dos átomos de carbono. La fórmula general de los caracteriza es \( C_n H_{2n} \), donde n es el número de átomos de carbono. Estos compuestos son más reactivos químicamente que los compuestos saturados.
El grupo de los alquinos responde a la fórmula general \( C_n H_{2n-2} \), donde n es el número de átomos de carbono. Los alquinos contienen un triple enlace entre dos átomos de carbono de la molécula. Son muy activos químicamente y no se presentan libres en la naturaleza. Forman un grupo análogo al de los alquenos.
De esta forma, los hidrocarburos formados por carbono e hidrógeno son los compuestos orgánicos de composición más simple y pueden utilizarse como base para hacer una clasificación de los compuestos orgánicos. La sustitución de uno o más átomos de hidrógeno por otro átomo o agrupación de átomos da origen a todos los tipos de compuestos orgánicos conocidos. Por ejemplo, si en un alcano se reemplaza un átomo de hidrógeno por un halógeno se obtiene un derivado halogenado. Por otro lado, si en un alcano sustituimos dos átomos de hidrógeno por uno de oxígeno podemos generar un aldehído (si la sustitución ocurre en un átomo de carbono terminal) o una cetona (si la sustitución se hace en un carbono intermedio).
Teniendo en cuenta estos conceptos básicos, los compuestos orgánicos se pueden clasificar en hidrocarburos e hidrocarburos sustituidos. Si la sustitución de átomos de hidrógeno se hace con átomos de oxígeno obtenemos compuestos oxigenados o funciones oxigenadas (alcoholes, fenoles, éteres, aldehídos, cetonas, ácidos, ésteres, sales).
Por otro lado, si se sustituyen átomos de hidrógeno por átomos de nitrógeno, hablaremos de compuestos nitrogenados o funciones nitrogenadas.
Compuestos orgánicos
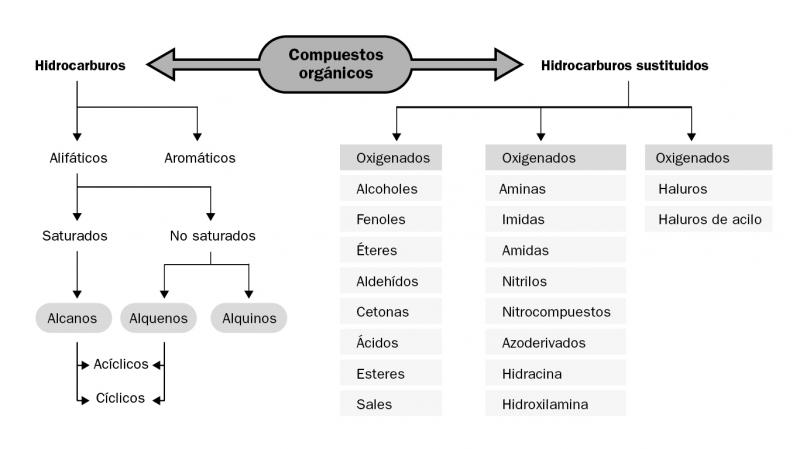
Elaboración propia.
Intoxicación por metanol
Si bien los productos orgánicos constituyen un avance científico-tecnológico en todas las áreas de la vida cotidiana, debemos tener en cuenta que la manipulación de hidrocarburos puede provocar cuadros de intoxicación grave. Un ejemplo es la intoxicación por metanol.
El metanol (alcohol de madera o alcohol de quemar) es un agente químico de uso industrial que se encuentra en numerosos productos de limpieza, anticongelantes, pinturas, barnices y bebidas alcohólicas adulteradas procedentes de destilerías clandestinas. Los cuadros de intoxicación por metanol son infrecuentes, pero a pesar de los diferentes tratamientos empleados, la mortalidad alcanza al 50% de las personas afectadas; y, en los casos no mortales, existe una gran cantidad de secuelas neurológicas.
El rango de tiempo de aparición de los síntomas descripto en la bibliografía oscila entre 1 y 72 horas. El metanol produce toxicidad en el sistema nervioso central. La toxicidad precoz resulta concordante con algunos de los síntomas descriptos como embriaguez o mareo, típicamente producidos por alcoholes y disolventes orgánicos. Un período de latencia de 12-24 horas y, por último, la aparición de síntomas más específicos atribuibles a la formación de metabolitos tóxicos. El inicio de la sintomatología clínica específica tiene lugar entre las 10 y las 30 horas desde la ingestión, incluso más tarde si existe consumo simultáneo de etanol. Los síntomas suelen ser molestias gastrointestinales inespecíficas seguidas de alteraciones de la visión, síntoma característico de la intoxicación por metanol. En intoxicaciones más graves aparece deterioro neurológico progresivo hasta la manifestación de convulsiones o coma.
En muchas ocasiones el diagnóstico es difícil de hacer. El tratamiento antidótico consiste en inhibir la transformación de metanol en sus metabolitos, por lo que para que sea efectivo debe instaurarse de manera temprana, antes de que se haya formado una cantidad importante del metabolito tóxico. El tratamiento habitual consiste en la administración de etanol, bicarbonato sódico y ácido fólico intravenoso.
Fuente: Villanueva et al. (2002).
1.4.1. Grupos funcionales
En un hidrocarburo, los átomos de hidrógeno pueden ser sustituidos por otros átomos (de cloro, oxígeno o nitrógeno, por ejemplo) o por un grupo de átomos, siempre que se respete el número correcto de enlaces químicos. Cuando el reemplazo se lleva a cabo por un conjunto de átomos, este grupo recibe el nombre de grupo funcional. Existen muchos grupos funcionales, y, además, distintos grupos pueden aparecer conjuntamente en una misma cadena carbonada. Esta característica es la que da origen a una gran variedad de compuestos orgánicos.
Los grupos funcionales son átomos o grupos de átomos unidos a cadenas de hidrocarburos alifáticas o aromáticas. En la fórmula general los compuestos alifáticos se representan como “R” y los aromáticos, como “Ar”. Los grupos funcionales son responsables de la reactividad y de las propiedades físico-químicas de los compuestos orgánicos.
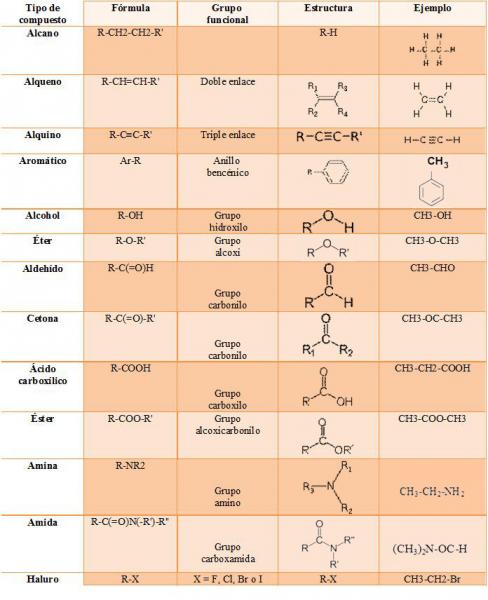
1.5. Introducción a las propiedades físicas y químicas de los hidrocarburos
Los átomos de carbono son capaces de unirse entre ellos a partir de enlaces simples, dobles o triples; debido a ello pueden formar tres tipos de hidrocarburos diferentes con el mismo número de carbono. Esta diversidad en los enlaces origina diferentes propiedades físicas y químicas.
1.5.1. Propiedades fisicoquímicas de los alcanos
Propiedades físicas
Los alcanos se presentan en los tres estados de agregación: sólido, líquido y gaseoso, lo que dependerá del número de átomos en la cadena principal. Los alcanos de bajo peso molecular son gases, los de cadena intermedia son líquidos y los alcanos con más de 18 átomos de carbono son sólidos a temperatura ambiente. De la misma manera, al aumentar el tamaño de la molécula se incrementa el punto de fusión y de ebullición, así como la densidad, cuyo valor es siempre menor que la densidad del agua. La mayoría de los alcanos son insolubles en agua, y solo se disuelven en solventes no polares, de la misma forma son excelentes disolventes de grasas y algunas ceras.
Propiedades químicas
Los alcanos son compuestos poco reactivos, no sufren transformaciones en presencia de metales, ácidos, bases o agentes oxidantes sin la participación de energía. Sin embargo, los alcanos son excelentes combustibles y, en presencia de oxígeno, arden bien y desprenden dióxido de carbono y agua.
Ejemplo: el compuesto más sencillo de la serie de los alcanos es el metano, de fórmula \( CH_4 \), combustible gaseoso y principal componente del gas natural.
1.5.2. Propiedades fisicoquímicas de los alquenos
Propiedades físicas
Los alquenos poseen propiedades físicas comparables a las de los alcanos, y su estado de agregación dependerá del número de átomos de carbono presentes en la molécula. De esta forma, los alquenos más sencillos son gases, los alquenos que contienen de 5 a 15 átomos de carbono son líquidos y los alquenos con más de 15 átomos de carbono se presentan en estado sólido. El punto de fusión se incrementa al aumentar el tamaño de la cadena, su densidad es menor a la del agua y solamente son solubles en solventes no polares.
Propiedades químicas
Son más reactivos que los alcanos debido a la presencia del doble enlace. Los alquenos, como los alcanos, son altamente combustibles y reaccionan con el oxígeno produciendo dióxido de carbono, agua y energía en forma de calor.Son reducidos fácilmente a alcanos por la adición de hidrógeno en el doble enlace.
Ejemplo: el etileno empleado como anestésico en cirugía, y, en gran escala, se utiliza para la maduración de frutas, como limones, manzanas, naranjas, plátanos, etcétera.
1.5.3. Propiedades fisicoquímicas de los alquinos
Propiedades físicas
Las propiedades físicas de los alquinos son similares a las de los alcanos y los alquenos de masas moleculares parecidas. Al igual que con los alcanos y alquenos, el estado de agregación de los alquinos dependerá del número de átomos de carbono presentes en la molécula. Los alquinos de cadena corta son gases, los que poseen de 5 a 15 átomos de carbono son líquidos y los alquinos mayores de 15 átomos de carbono se encuentran en estado sólido.
Son compuestos de baja polaridad y, por tener propiedades semejantes a las de los alcanos y alquenos, también su densidad es menor a la del agua, los puntos de fusión y ebullición se incrementan al aumentar el tamaño de la cadena y solamente son solubles en solventes no polares.
Propiedades químicas
Las reacciones químicas de los alquinos son semejantes a las de los alquenos, reaccionan con el oxígeno formando dióxido de carbono, agua y energía. Sin embargo, la energía liberada es superior en los alquinos: mayor cantidad de energía por mol de producto formado.
1.6. Usos y aplicaciones
Existen en la actualidad millones de compuestos de carbono que varían en su composición y función. Forman parte de los componentes esenciales de toda la materia viva.
Las aplicaciones de los alcanos dependen del número de átomos de carbono en la molécula. Los primeros cuatro alcanos se utilizan principalmente como combustible para calefacción y cocción de los alimentos. El propano, de 3 átomos de carbono, se encuentra en el gas doméstico. El butano, formado por 4 carbonos, está presente en los encendedores.
Los alcanos de cadena intermedia se utilizan como combustible en los motores de combustión interna, como los de los automóviles. Los alcanos más pesados forman parte del asfalto en las carreteras y de los productos impermeabilizantes. Además, pueden utilizarse como materia prima para la obtención de polímeros.
El doble enlace presente en los alquenos puede reaccionar fácilmente y dar lugar a otros grupos funcionales. Esta característica permite que sean importantes intermediarios en la síntesis de diferentes compuestos. Además, son precursores de polímeros, productos farmacéuticos y productos químicos.
Entre los alquenos de mayor importancia industrial se encuentran el eteno o etileno, y el propeno o propileno. Estos compuestos se utilizan para sintetizar cloruro de vinilo, polipropileno y tetrafluoroetileno.
Por otra parte, los alquenos forman compuestos coloridos, como el licopeno y betacaroteno, presentes en frutas y verduras.
Los alquinos se emplean principalmente como combustibles. El de mayor importancia comercial es el acetileno o etino, de 3 átomos de carbono.
En la industria química, los alquinos son importantes precursores en la síntesis del PVC y del caucho artificial. Los polímeros generados a partir de los alquinos, los polialquinos, son materiales semiconductores orgánicos, flexibles y largos.
En este recurso audiovisual se hace un breve repaso de las propiedades físicas y químicas, y de las aplicaciones de los hidrocarburos. Por otra parte, introduce los temas del capítulo siguiente.
“Hidrocarburos: alcanos, alquenos, alquinos” (Escuela Superior Politécnica de Chimborazo, en español, duración: 4:58 min.).
-
Busque al menos tres ejemplos de compuestos orgánicos en la naturaleza e investigue su importancia y aplicación.
-
Investigue sobre el petróleo teniendo en cuenta las siguientes cuestiones:
- ¿Qué productos de uso diario se obtienen a partir del petróleo?
- El petróleo, ¿es un recurso renovable o no renovable?
- ¿Cuáles son las consecuencias de los derrames de petróleo para el medioambiente?
- ¿Qué productos son derivados del petróleo?
-
Investigue acerca de la producción, venta y distribución de petróleo y sus derivados en Argentina.
-
Indique si son verdaderas o falsas las siguientes afirmaciones. Justifique las respuestas incorrectas.
- La cantidad de compuestos inorgánicos es mucho mayor que la de compuestos orgánicos.
- Las proteínas son macromoléculas de origen orgánico.
- Los compuestos orgánicos pueden contener una gran variedad de elementos.
- Muchas sustancias orgánicas tienen interés energético e industrial.
- Los hidrocarburos de cadena corta poseen puntos de fusión mayores que los de cadena intermedia o larga.
- Los alcanos poseen mayor densidad que el agua.
- Los alcanos son más reactivos que los alquinos.
- Los enlaces internos de los compuestos orgánicos son covalentes.

