3. Compuestos halogenados
Objetivos
- Aplicar la metodología de la nomenclatura IUPAC de compuestos orgánicos halogenados.
- Reconocer los diferentes compuestos orgánicos halogenados.
- Comparar las propiedades físicas y químicas de los distintos compuestos de este grupo.
3.1. Introducción
Los halógenos son un grupo de elementos que se encuentran ubicados en el grupo 17 o grupo VII A de la tabla periódica y son similares en sus propiedades químicas. Los halógenos en estado natural se encuentran siempre como una molécula diatómica y presentan una gran tendencia a combinarse.
Los halogenuros o haluros de alquilo derivan de los hidrocarburos, en los que uno o más hidrógenos se sustituyen por halógenos; este átomo está unido por un enlace covalente a un átomo de carbono, y su fórmula general es R-X. Son compuestos altamente reactivos debido a la presencia del halógeno. A partir de los halogenuros se sintetizan numerosos compuestos orgánicos.
3.2. Generalidades
Los halogenuros de alquilo presentan puntos de ebullición mayores que los alcanos con el mismo número de carbonos y, además, este valor va aumentando con la masa atómica del halógeno.
A pesar de su polaridad son insolubles en agua, ya que no pueden formar puentes de hidrógeno, pero solubles en disolventes orgánicos no polares como el éter de petróleo y el benceno. Tienen puntos de fusión mayores que los alcanos. Los derivados halogenados participan en reacciones de sustitución que permiten obtener con cierta facilidad otros compuestos orgánicos importantes, tales como alcoholes, éteres, alcanos, etc. La densidad con respecto al agua depende del tipo de halógeno. Los fluoruros y cloruros son menos densos, en cambio, los yoduros y bromuros presentan una mayor densidad.
Los derivados halogenados se emplean como anestésicos o antisépticos en medicina, como disolventes en la industria química, para la fabricación de extintores de incendios, insecticidas, polímeros fluorados como el teflón y refrigerantes. Algunos derivados halogenados, como los fluidos que se utilizan en sistemas refrigerantes y aerosoles, conocidos como freones, se consideran perjudiciales para el medioambiente (G.3.1).
| COMPUESTO | APLICACIÓN | FÓRMULA |
|---|---|---|
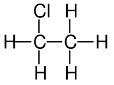
| Cloroetano o cloruro de etilo | Analgésico total, se usa en pequeñas intervenciones médicas, como perforación de orejas y en biopsias de la piel. En el pasado se usó como aditivo de gasolina. Otras aplicaciones: producción de celulosa, tinturas, medicamentos, y el uso como disolvente y refrigerante. |
|
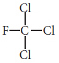
| Freones | Tienen bajo punto de ebullición. Se usan como espumantes para plásticos, refrigerantes, lacas para el cabello y productos de limpieza. Usos propelentes como gases en latas de aerosoles (producen cambios climáticos como el efecto invernadero y calentamiento global). |
|
| P-diclorobenceno | Insecticida, repelente para polillas y fumigante contra el moho. |

|
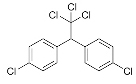
| DDT El dicloro difenil tricloroetano (DDT) | Insecticida organoclorado sintético de amplio espectro, acción prolongada y estable, aplicado en el control de plagas para todo tipo de cultivos desde la década del cuarenta. |
|
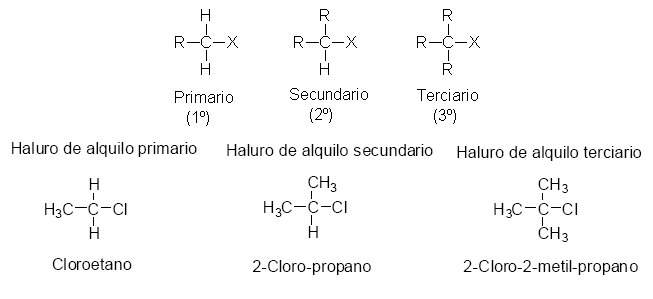
Clasificamos un átomo de carbono como primario, secundario o terciario, según el número de otros átomos de carbonos unidos a él. De la misma forma, los halogenuros de alquilo se clasifican en primarios, secundarios o terciarios según la posición del carbono al que está unido el halógeno. Cuando el átomo de carbono que lleva el halógeno está unido a un único átomo de carbono se denomina carbono primario y el haluro de alquilo es primario. Si el carbono unido al halógeno está a su vez unido a dos átomos de carbono es un carbono secundario y el haluro de alquilo es secundario, y de igual forma sucede con los haluros de alquilo terciarios.
Clasificación de los haluros de alquilo
3.3. Nomenclatura general
Para nombrar los compuestos halogenados se utilizan las reglas IUPAC de los alcanos, donde los halógenos se consideran un sustituyente más de la cadena principal.
Las reglas para nombrarlos son similares a las de los hidrocarburos, con algunas pequeñas diferencias:
- Identificar la cadena principal.
- Enumerar la cadena principal, comenzando por el extremo que contenga más cerca el halógeno.
- Indicar la posición del halógeno en la cadena carbonada, este número se antepone al nombre.
En la nomenclatura común, se nombra el halogenuro como fluoruro, cloruro, bromuro o yoduro, seguido del nombre del radical alquilo correspondiente y se le añade el sufijo -ilo.
Ejemplo de nomenclatura de halogenuros de alquilo
Escriba las fórmulas estructurales de los siguientes derivados de alquilo:
- 2-cloropropano
- 1,2-dibromoetano
- 2-cloro-2-metilpropano
- 2-cloro-3-etil-4-metilpentano
- 1-cloro-3-metilciclobutan
Elija cuál es el nombre que corresponde a la siguiente estructura:
\(CH_3-CH_2-CH_2-CH_2-I\)
- Butano
- Yodobutano
- 1-Yodobutano
- 4-yodobutano
Complete la siguiente tabla
|
Compuesto |
Nomenclatura IUPAC |
Nomenclatura común (si corresponde) |
Clasificación |
|---|---|---|---|
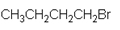
|
Primario |
||
|
2-cloropropano |
|||
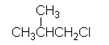
|
De isopropilo |
||
2-yodo-2-metilbutano |
|
Terciario |
|

|
|
NC |
|
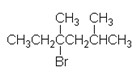
|
|
El cloroetano, llamado también cloruro de etilo, es un gas incoloro a temperatura y presión ambiental, de olor penetrante característico. El uso más extendido del cloroetano en el pasado fue la producción de tetraetilo de plomo, un aditivo de la gasolina. Actualmente, este uso ha disminuido considerablemente debido al control de la concentración de plomo en la gasolina. Se emplea en la producción de celulosa, tinturas, medicamentos, disolventes y refrigerantes.
Los seres humanos pueden estar expuestos al cloroetano proveniente de fuentes ambientales, ocupacionales o de consumo, como solventes, pinturas y refrigerantes. Esta exposición al cloroetano puede ser a través de contacto con la piel, al usarlo como agente para adormecer la piel antes de la perforación de orejas, biopsias de la piel, para tratar lesiones deportivas y por otras razones médicas.
La exposición ocupacional puede ocurrir a través de inhalación o contacto con la piel. Entre los trabajadores que pueden estar expuestos al cloroetano se incluyen médicos, enfermeras y otros trabajadores de la salud, mecánicos de automóviles, mecánicos de máquinas de oficinas, personas que arman o instalan artículos y accesorios domésticos, pintores profesionales, mecánicos de industria pesada, mecánicos de motores diésel, plomeros e instaladores de cañerías.
La mayor parte del cloroetano liberado al ambiente termina en forma de gas en la atmósfera, mientras que cantidades mucho más pequeñas se filtran al agua subterránea a través del suelo. La presencia de cloroetano en el aire puede ser atribuida a su liberación desde industrias que lo manufacturan o lo usan, a la evaporación desde vertederos, disolventes, refrigerantes y anestésicos, y a la liberación en el humo generado al quemar plásticos u otros materiales de desecho. Una vez en la atmósfera, se necesitan aproximadamente 40 días para que la mitad de la cantidad de cloroetano en el aire desaparezca.
En el agua subterránea se transforma lentamente en etanol y en una sal clorhídrica como resultado de la reacción con agua. Con base en la escasa información disponible acerca de la presencia de cloroetano en el agua potable es posible concluir que niveles extremadamente bajos pueden formarse en algunos suministros de agua potable durante la cloración, por la contaminación de ríos y lagos usados como suministros.
La exposición breve a altos niveles de cloroetano puede producir una sensación de embriaguez transitoria; los niveles aún más altos provocan incoordinación muscular y pérdida del conocimiento. Inhalar cloroetano ha producido mareo y disminución del tiempo de reacción en adultos. También se han registrado calambres estomacales, náusea, vómitos e irritación de los ojos luego de inhalar brevemente altas concentraciones. En trabajadores que respiraron vapores de cloroetano durante 1.5 a 3 años (la concentración no se especificó) se ha observado un aumento en la susceptibilidad para contraer enfermedades. Las consecuencias más serias de la exposición prolongada a altas concentraciones de cloroetano se observan principalmente en el sistema nervioso.
Fuente: Agencia para el Registro de Sustancias Tóxicas y Enfermedades (ATSDR).
En este video podemos comprender cuál fue el impacto del descubrimiento del DDT en el mundo.
“Historia del DDT” (en español, duración: 2:49 min.).
Diclorodifeniltricloroetano
El DDT es un insecticida organoclorado sintético de acción no selectiva, prolongada y estable, aplicado en el control de plagas para todo tipo de cultivos desde la década del cuarenta. Constituye un producto de elevada toxicidad ambiental y humana y de escasa o nula biodegradabilidad, razón por la cual, en muchos países, su uso fue restringido y/o prohibido.
Su potencial ecotóxico reside en que mata a los insectos por contacto, afectando su sistema nervioso. Su efecto tóxico, luego de ser aplicado, se conserva durante años; por ejemplo, un campo tratado con DDT conserva, luego de diez años, el 50% de la cantidad aplicada.
Pero el uso del DDT no se limitó a las plantaciones. En 1955, la Organización Mundial de la Salud puso en marcha un programa mundial para la erradicación de la malaria basado en la aplicación masiva de DDT en los hogares. El plaguicida se mostró muy útil para poner freno a algunas enfermedades endémicas, como la mencionada malaria o la fiebre amarilla.
Este producto permitió mejorar sensiblemente el rendimiento de las cosechas destinadas a la alimentación humana y significó un importante elemento en la denominada Revolución Verde de la agricultura. Lamentablemente, su uso indiscriminado y su mal manejo aparejaron las consecuencias ecotóxicas mencionadas.
El consumo humano de alimentos de origen animal contaminados con DDT provoca su acumulación y posterior intoxicación; los casos agudos presentan alteraciones gastrointestinales, trastornos neurológicos y parálisis muscular; si la dosis es elevada puede sobrevenir la muerte por paro respiratorio.
Fuente: <https://www.mendoza.conicet.gov.ar/portal/enciclopedia/terminos/DDT.htm>
En este video se expone el impacto de los CFC (compuestos con carbono, flúor y cloro) en la capa de ozono y sus consecuencias en el medioambiente.
“El ataque de los CFC a la capa de ozono” (en español, duración: 5:37 min.).
Luego de observar con atención el recurso audiovisual, investigue qué moléculas son los CFC, su estructura, aplicación y su impacto en el medioambiente. Explique normativas de empleo y elabore una conclusión.

