4. Propiedades de gases, líquidos y sólidos
Objetivos
- Conocer las propiedades macroscópicas de los tres estados de agregación.
- Comprender cómo el comportamiento microscópico de las partículas que forman un material determinan sus propiedades macroscópicas.
- Conocer los cambios de estado y saber si van acompañados de absorción o liberación de calor.
- Entender la diferenciación entre sólidos cristalinos y amorfos.
- Saber qué son la viscosidad y la tensión superficial de un líquido.
- Conocer las leyes de los gases y la escala Kelvin de temperatura.
4.1. Los estados de agregación de la materia
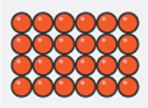
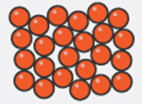
Los materiales se presentan habitualmente en tres estados de agregaciónN: sólido, líquido y gaseoso. Cada uno tiene propiedades características que permiten diferenciarlo de los otros dos, aunque en determinadas circunstancias hacer esta diferenciación no resulta tan sencillo (ver apartado “Para ampliar”). Además, un mismo material puede cambiar su estado de agregación si se modifica su temperatura o la presión a la que está sometido. Entonces cabe preguntarse: ¿qué es lo que determina el estado de agregación de un material? La respuesta es sencilla si se conocen algunos resultados fundamentales de una rama de la ciencia denominada termodinámica estadística, que veremos en el apartado siguiente. Pero antes de llegar a ese punto debemos indicar cuáles son las características distintivas de cada estado de agregación.
Además de los tres estados de agregación, existen otros estados de agregación como el plasma o el supersólido, pero son mucho menos habituales.
Termodinámica estadística
La termodinámica estadística (o mecánica estadística) es una rama de la física que nos muestra de qué manera el comportamiento observado de los sistemas materiales es una consecuencia lógica de los movimientos y las fuerzas de interacción entre los átomos o moléculas que componen tales materiales. Aunque en esta unidad presentaremos los principales resultados de la termodinámica estadística en forma simplificada y cualitativa, es importante tener en cuenta que también permite hacer predicciones cuantitativas de gran exactitud. Además, esta rama de la física provee de fundamentos a los métodos de simulación computacional, de gran utilidad en las investigaciones actuales de los sistemas materiales.
Los materiales en estado sólido se caracterizan por tener forma y volumen propios. Los gases son el extremo opuesto, ya que no tienen ni forma ni volumen propio sino que adquieren el volumen y la forma del recipiente que los contiene. Los materiales líquidos tienen un comportamiento intermedio: tienen un volumen propio, pero adaptan su forma a la del recipiente que los contiene. Además, los gases son fácilmente compresibles. Esto significa que su volumen se puede reducir con relativa facilidad si se aumenta la presión a la que está sometido el gas. Por el contrario, líquidos y sólidos son prácticamente incompresibles, ya que se requieren enormes variaciones de presión para lograr cambios ínfimos en su volumen.
Fuente: adaptado de <https://www.ducksters.com/science/solids_liquids_gases.php>.
Dos palabras para un mismo estado de agregación
Nuestro idioma, así como el idioma inglés, tiene dos palabras alternativas para hacer referencia a un material en estado gaseoso. Podemos decir que es un gas o que es un vapor, aunque en realidad ambos vocablos tienen el mismo significado. La existencia de dos palabras diferentes para referir a la misma cosa tiene orígenes históricos. Las sustancias que se encuentran en estado gaseoso pueden ser convertidas al estado líquido por compresión o enfriamiento, o por una combinación de ambos procesos. Sin embargo, algunos gases requieren temperaturas extremadamente bajas para transformarse en líquidos. El nitrógeno, por ejemplo, pasa a líquido solo si se enfría por debajo de -211 °C, mientras que el hidrógeno requiere llegar a una temperatura de -259 °C. Durante los siglos XVII y XVIII, cuando se hicieron los primeros estudios científicos sobre el comportamiento de los gases, era imposible alcanzar temperaturas tan bajas. Por este motivo, los científicos de esa época llamaron vapores a las sustancias que podían pasar a líquido solo por compresión. Los gases permanentes, o simplemente gases, requieren de la combinación de compresión y enfriamiento para convertirse en líquidos.
4.2. Una visión microscópica de los estados de agregación
La termodinámica estadística nos enseña que las propiedades observadas en los materiales son el resultado promediado del comportamiento de sus partículas. Estas partículas se mueven y por ello tienen energía cinética. Además interaccionan entre sí, a veces se atraen y a veces se repelen; y por ello tienen también una energía potencial. Cuando la energía de las interacciones prevalece sobre la energía de movimiento, las partículas apenas pueden desplazarse y realizan pequeñas oscilaciones en torno a posiciones fijas. Esa situación es la que se observa en el estado sólido. Por el contrario, cuando la energía de las interacciones es insignificante en comparación con la energía cinética, las partículas se mueven libremente por todo el recipiente que las contiene. Esa es la situación que se observa en los gases. Por último, cuando ninguna de las dos energías prevalece, las partículas se mueven unas sobre otras, con gran dificultad, pero permanecen en conjunto cohesionadas, manteniendo entre sí pequeñas distancias. Esa es la situación que se observa en los líquidos.
Como se mencionara en la Unidad 3, las fuerzas de interacción entre partículas dependen de la distancia que las separa. A grandes distancias no hay interacción. A distancias intermedias o cortas hay fuerzas atractivas. Pero si las distancias se vuelven extremadamente cortas predominan las fuerzas de repulsión. Las fuerzas atractivas son las que permiten que una sustancia pueda pasar del estado gaseoso al estado líquido y del líquido al sólido. En contra de estas fuerzas atractivas actúa la energía de movimiento de las partículas. Esta energía tiende a liberar las partículas de su mutua atracción. Ahora bien, la energía cinética de las partículas aumenta cuando aumenta la temperatura. Por ello, a pesar de la existencia de las fuerzas atractivas, los materiales pueden transformarse de sólido a líquido y de líquido a gas si su temperatura se aumenta lo suficiente. Las fuerzas de repulsión se manifiestan solo cuando la distancia entre partículas es extremadamente pequeña y son las responsables de que no pueda haber dos partículas exactamente en el mismo punto o en puntos muy próximos. La Tabla 4.1 ilustra las características microscópicas más destacadas de cada uno de los tres estados de agregación.
El hecho de que los líquidos y sólidos sean prácticamente incompresibles es una demostración incontrastable de que existen fuerzas de repulsión entre las partículas que los componen. Por otra parte, el hecho de que los gases puedan ser condensados a líquido y luego los líquidos transformados en sólidos es una demostración incontrastable de la existencia de fuerzas de atracción entre partículas.
Como ya se mencionó, las fuerzas atractivas son intensas a distancias intermedias, mientras que las fuerzas de repulsión son intensas a distancias muy cortas. Entre estos dos límites existe un punto exacto, una distancia para la cual las fuerzas de repulsión y atracción se compensan exactamente. Dicha distancia se conoce como distancia de equilibrio. En ausencia de cualquier energía de movimiento, las partículas permanecerían fijas a la distancia de equilibrio. Sin embargo, si se aumenta la energía de movimiento por un aumento de la temperatura, las partículas pueden desviarse de sus posiciones de equilibrio, primero haciendo pequeños desplazamientos (estado sólido), luego moviéndose un poco más de manera tal de desplazarse unas sobre otras (estado líquido) y por último escapando completamente (estado gaseoso).
En algunos libros de texto se indica que la existencia de los tres estados de agregación se debe al balance que se establece entre las fuerzas de atracción y repulsión entre partículas. Este concepto es erróneo. Lo que determina el estado de agregación de un material es el balance entre la energía de movimiento de sus partículas y la energía de su mutua interacción medida en el punto de equilibrio.
|
Estado |
Sólido |
Líquido |
Gaseoso |
|
Esquema |
|
|
|
|
Arreglo de las partículas |
Regular - Ordenado |
Aleatorio - Sin orden |
Aleatorio - Sin orden |
|
Movimiento de las partículas |
Vibran alrededor de posiciones fijas |
Se mueven unas sobre otras |
Se mueven en todas direcciones con diferentes velocidades |
|
Proximidad de las partículas |
Muy próximas |
Muy próximas |
Muy separadas entre sí |
4.3. Los cambios de estado de agregación
El estado de agregación de un material, como ya se mencionó –y se deriva de la discusión precedente–, se puede variar si se modifican las condiciones de presión y temperatura a las que es sometido. Cada cambio de estado de agregación recibe un nombre particular, como se muestra en el Gráfico 4.2.
El cambio de estado de agregación de sólido a líquido recibe el nombre de fusión, mientras que el cambio inverso, de líquido a sólido, se llama solidificación, aunque a veces, en el lenguaje coloquial, nos referimos a este cambio como congelación. El cambio de fase de líquido a vapor recibe el nombre de vaporización, mientras que el cambio inverso, de gas a líquido, se llama condensación. Como se discute en mayor profundidad en el siguiente recurso “Para ampliar”, la vaporización puede tener lugar por dos mecanismos diferentes: la evaporación o la ebullición. Aunque no es lo más habitual, los cambios de estado de agregación directos entre sólido y gas (sin pasar por el estado líquido) también pueden ocurrir. El pasaje directo del estado sólido al gaseoso se denomina sublimación y el pasaje inverso recibe diversos nombres. Entre los más utilizados podemos mencionar: sublimación regresiva, sublimación inversa y deposición.
A una determinada presión externa, todos los cambios de estado de agregación ocurren a una temperatura definida, excepto la evaporación. La temperatura a la cual se produce la transformación entre el estado sólido y el estado líquido se llama punto de fusión. Podría llamarse igualmente punto de congelación o solidificación, pero esta denominación es menos habitual. Asimismo, la temperatura a la cual una sustancia pasa del estado líquido al estado vapor por el mecanismo de ebullición recibe el nombre de temperatura o punto de ebullición. Por último, para las sustancias que subliman, es posible definir un punto de sublimación. Es importante notar que los puntos de fusión, ebullición y sublimación dependen de la presión externa. Si se cambia la presión externa, todos estos puntos se modifican y por este motivo se suele indicar el valor de presión a la que se informan estas temperaturas. Las temperaturas a las que ocurren los cambios de estado de agregación se denominan temperaturas o puntos normales si la presión externa es igual a la presión normal P=101,325 Pascales.
La presión externa es también la que determina si una sustancia sólida va a sublimar o fundirse al ser calentada. El hielo y el hierro, mantenidos a la presión atmosférica, se funden al ser calentados, mientras que el dióxido de carbono y el yodo subliman. El dato clave para determinar cuál de los dos procesos va a ocurrir es la presión del llamado punto triple. El punto triple de una sustancia es una combinación de temperatura y presión a la cual los tres estados de agregación de esa sustancia pueden coexistir en equilibrio. El punto triple del agua, por ejemplo, es de 0,01 °C de temperatura y 0,006 atm de presión. El punto triple del dióxido de carbono en cambio es de -56,60 °C y 5,10 atm. Un sólido sublima si la presión a la que está sometido es inferior a la presión de su punto triple y se funde en caso contrario. En la superficie de la Tierra, la presión atmosférica es cercana a 1,0 atm. Esta presión es mayor que la presión del punto triple del agua, pero inferior a la presión del punto triple del dióxido de carbono. Por este motivo, el dióxido de carbono sublima mientras que el agua se funde.
En el siguiente video encontrarán experimentos que se pueden realizar con recursos caseros y dióxido de carbono sólido (también llamado hielo seco). Todos los experimentos se basan en la capacidad de esta sustancia de sublimar a la presión atmosférica normal a nivel del mar.
<https://www.youtube.com/watch?v=oZXw7gMYU-U> Fuente: (Publicado por revista Correo del Maestro, 21 de enero de 2016.
[Consulta: 12 de abril 2017]).
La diferencia entre la evaporación y la ebullición
El ejemplo para abordar este tema es ampliamente conocido por todos: el agua. Sabemos, por nuestra propia experiencia, que el agua líquida puede pasar a vapor a muchas temperaturas diferentes. Este proceso es el que permite que la ropa recién lavada y tendida eventualmente se seque, como se secan los vasos y platos que dejamos escurriendo en un secaplatos. Todos estos son ejemplos de procesos de evaporación del agua.
La evaporación es más rápida a temperaturas elevadas, pero también ocurre a temperaturas bajas. También es más rápida cuanto mayor es la superficie del objeto que queremos secar. Por ello conviene estirar bien la ropa antes de tenderla en vez de colgarla hecha un bollo. Por último, la evaporación es más rápida si el aire es seco que si el aire es húmedo. Los días de alta humedad, aunque sean cálidos, cuesta secar la ropa. En cualquier caso, lo que queda claro de estos ejemplos es que el agua pasa del estado líquido al vapor sin llegar a la ebullición, la cual ocurre a una temperatura de 100 °C a nivel del mar.
Además, la evaporación es un fenómeno que tiene lugar en la superficie del líquido. Algunas de las moléculas que se encuentran sobre la superficie del líquido –las que tienen más energía de movimiento– logran pasar al estado vapor. Si el recipiente está abierto, las moléculas que pasaron al vapor se escapan y ya no regresan. Esto lleva a que, eventualmente, todo el líquido se evapore. Por el contrario, si el recipiente está cerrado, las moléculas que van pasando a la fase vapor no pueden escapar. Entonces empieza a ocurrir el proceso contrario: algunas de las moléculas que se encuentran en la fase vapor colisionan contra la superficie del líquido y quedan retenidas en él (en otras palabras, se condensan). Se llega así a un estado de equilibrio en el cual la cantidad de moléculas que pasan del líquido al vapor es igual a la cantidad que pasa del vapor al líquido. La presión que ejerce el vapor en esa situación de equilibrio se llama presión de vapor del líquido y aumenta con el aumento de temperatura. Estas dos situaciones se ilustran en el Gráfico 4.3.
La ebullición es un fenómeno que tiene lugar en todo el líquido, tanto en la superficie como en su seno. Para cada presión externa, ocurre a una única temperatura. La manifestación más clara de que la ebullición es un fenómeno que compromete a todo el líquido, y no solo a las partículas superficiales, es la formación de burbujas. Estas burbujas corresponden a partículas que se evaporaron estando en el seno del líquido: como son menos densas que el líquido, terminan moviéndose hacia arriba, hasta que finalmente logran escapar del seno del líquido a través de su superficie (ver Gráfico 4.4).
A la izquierda, la evaporación: ocurre en la superficie del líquido y tiene lugar en un amplio rango de temperaturas. A la derecha, la ebullición: compromete a toda la masa de líquido; para cada presión externa, tiene lugar a una temperatura dada.
Fuente: adaptado de <https://courses.lumenlearning.com/cheminter/chapter/boiling-point/>.
Por último, una característica importante de los cambios de estado de agregación es que todos involucran la transferencia de grandes cantidades de energía, generalmente en forma de calor. Si se entrega calor a un material sólido, su temperatura irá en aumento. Pero este proceso no continúa de manera indefinida, sino que puede llegar, como máximo, a la temperatura de fusión del material. Una vez alcanzado el punto de fusión, el calor entregado al material ya no se utiliza para elevar su temperatura, sino que se invierte en realizar el cambio de estado de agregación, lo que requiere liberar a las partículas de las fuerzas de su mutua interacción. Solo cuando todo el material se ha transformado al estado líquido, la entrega de calor vuelve a usarse para calentar el material, que ahora se encuentra en estado líquido. Este proceso de calentamiento del líquido puede continuar, como máximo, hasta que se alcanza la temperatura de ebullición. Al llegar a dicho punto, todo el calor entregado se utiliza para transformar el material del estado líquido al gaseoso. Este proceso se ilustra en el Gráfico 4.5, donde se muestra una típica curva de calentamiento.
En un gráfico realizado en coordenadas cartesianas, se denomina eje de abscisas al eje x y en él usualmente se representa el parámetro variable. El eje y, por su parte, se denomina eje de ordenadas y en él se representa la función del parámetro variable x.
4.4. El estado sólido
Los sólidos pueden ser de dos tipos distintos: cristalinos o amorfos. Un sólido cristalino es aquel cuyas partículas se encuentran perfectamente ordenadas, ocupando posiciones bien definidas en una red tridimensional y de acuerdo a un cierto patrón. Este patrón que se repite en las tres direcciones se conoce como celda unitaria. El Gráfico 4.6 muestra algunos ejemplos de celdas unitarias. Los sólidos cristalinos suelen tener superficies planas, con caras que forman ángulos bien definidos entre sí.
Fuentes: <https://www.doitpoms.ac.uk/tlplib/electromigration/alternatives.php?printable=1>, <https://crystallography365.wordpress.com/2014/10/27/solid-carbon-dioxide/> y <https://www.transtutors.com/questions/cesium-chloride-forms-a-simple-cubic-lattice-in-which-cs-ions-are-at-the-corners-and-725450.htm>.
Los sólidos amorfos son aquellos cuyas partículas no tienen una estructura ordenada, por lo que carecen de formas y caras bien definidas. Estos sólidos se generan cuando, debido a su forma o tamaño, las moléculas del material no logran disponerse de manera regular. A nivel molecular, un sólido amorfo es como un líquido, solo que sus partículas no tienen la capacidad de moverse unas sobre otras. Por este motivo, hay quien considera a los sólidos amorfos como líquidos sobreenfriados. Además, mientras que los sólidos cristalinos tienen puntos de fusión bien definidos, los sólidos amorfos solo se van reblandeciendo en forma paulatina al ser calentados. Esto corresponde a la visión de un líquido sobreenfriado con una viscosidad extremadamente grande, que por aumento de la temperatura disminuye su viscosidad a valores normales y recupera su capacidad de fluir. Entre los sólidos amorfos más conocidos podemos destacar el vidrio y la cera utilizada para depilación.
4.5. El estado líquido
El estado líquido, como ya se describió, es un estado en el cual las partículas que componen el material están muy próximas entre sí, pero no ocupan posiciones fijas, sino que pueden desplazarse unas sobre otras. A nivel macroscópico hay dos propiedades muy importantes que caracterizan el estado líquido: la viscosidad y la tensión superficial.
La viscosidad es una propiedad de los líquidos que mide la facilidad con que fluyen. Por ejemplo, el aceite utilizado para lubricar los motores o la vaselina son líquidos que fluyen con lentitud y dificultad, mientras que el agua o el alcohol fluyen con gran facilidad. Esto se debe a que el aceite del motor y la vaselina tienen mayor viscosidad que el agua y el alcohol. Los líquidos suelen ser transportados de un punto a otro a través de cañerías. Cuanto mayor es la viscosidad del líquido, más difícil resulta el transporte y más costoso en términos de la energía requerida.
La viscosidad de los líquidos depende de la temperatura. Como regla general, a mayor temperatura menor viscosidad. En algunos casos, como el del agua y el alcohol, la viscosidad del líquido es independiente de las fuerzas que se apliquen para provocar su deformación y su movimiento; tales líquidos reciben el nombre de fluidos newtonianos. En otros casos, como el de los pegamentos o las mezclas de agua y almidón, la viscosidad depende de la fuerza aplicada para deformar el líquido; entonces, el líquido se clasifica como no newtoniano.
El siguiente video muestra el extraño comportamiento de una mezcla no newtoniana de agua y maicena. ¡Se puede incluso caminar sobre ella!
<https://www.youtube.com/watch?v=QPg2XkGXF1I>
Otra característica importante de los líquidos es que su superficie y su seno tienen propiedades diferentes. En buena medida, es correcto considerar la superficie de un líquido como una “piel”, aunque muy delicada, que lo recubre. Esta delicada piel que envuelve al líquido es la responsable de que forme pequeñas gotas al ser dispersado y permite que ciertos insectos puedan caminar sobre la superficie del agua sin hundirse.
La tensión superficial permite que algunos insectos caminen sobre el agua sin hundirse.
Este comportamiento aparentemente extraño de la superficie se debe a que las moléculas que están en el seno del líquido son atraídas en todas las direcciones por las moléculas que las rodean. Sin embargo, esto no ocurre con las moléculas que están en la superficie del líquido, ya que hay muy pocas moléculas de la sustancia en cuestión en la fase gaseosa. Por este motivo, las moléculas de la superficie son atraídas hacia el seno del líquido, lo que tiende a reducir el área superficial. Debido a este comportamiento se requiere energía para agrandar la superficie de un líquido, y la tensión superficial es una medida de la energía requerida para lograr tal efecto. A mayor tensión superficial, más difícil es agrandar el área de la superficie del líquido.
4.6. El estado gaseoso
De los tres estados de agregación, el estado gaseoso es el más sencillo de describir, especialmente cuando el volumen que ocupa el gas es grande en comparación con la cantidad de moléculas que tiene. En tales circunstancias, las partículas que componen el gas están muy separadas entre sí y se dice que el gas está “diluido”. Todos los gases diluidos se comportan exactamente de la misma manera, independientemente de cuál sea la sustancia que se encuentra en el estado gaseoso. Cuando se cumplen esas condiciones se dice que el gas se comporta como un gas ideal.
Hay tres parámetros o variables que se pueden utilizar para describir el estado de una masa dada de gas. Estas variables son el volumen que ocupa el gas, que se representa con la letra V; la presión que ejerce el gas sobre las paredes del recipiente que lo contiene, que se representa con la letra P, y la temperatura a la que se encuentra el gas, que se representa con la letra T. Todos los experimentos realizados con gases que se comportan como ideales demuestran que estos tres parámetros no pueden variarse de manera arbitraria, sino que, si uno de ellos se mantiene constante, las variaciones de los otros dos están perfectamente correlacionadas. En los próximos párrafos desarrollaremos este tema con mayor profundidad.
Comenzamos considerando una masa dada de gas mantenida a temperatura constante. En tales condiciones se observa que la presión que ejerce el gas es inversamente proporcional al volumen que este ocupa. ¿Qué significa esto en términos prácticos? Que si la presión se duplica, el volumen se reduce a la mitad; si la presión se cuadruplica, el volumen se reduce a un cuarto, y si la presión se multiplica por diez, entonces el volumen se reduce a un décimo. Obviamente, vale también lo opuesto. Si la presión se reduce a la mitad, el volumen se duplica; si P se reduce a un cuarto, V se cuadruplica, y si P se reduce a un décimo de su valor inicial, entonces el volumen se multiplica por diez.
Notar cómo el volumen del gas contenido en el cilindro se reduce a la mitad cuando se duplica la presión ejercida sobre el émbolo a cantidad de gas y temperatura constantes.
Fuente: adaptado de <http://slideplayer.com/slide/3836528/>.
Expresado en forma matemática, la proporcionalidad inversa se indica mediante:
\(P=\frac{C}{V}\)(4.1)
donde C es una constante que depende de la temperatura; cuanto mayor sea la temperatura a la cual se mantiene el gas, mayor será la constante C. La ley descrita por la ecuación 4.1 se conoce como Ley de Boyle y Mariotte, en honor a los dos científicos que la descubrieron en forma independiente.
Ley de Boyle-Mariotte: a temperatura constante, el volumen de una masa dada de gas es inversamente proporcional a la presión ejercida sobre él. Matemáticamente, la Ley de Boyle-Mariotte se expresa con la ecuación 4.1.
El gráfico permite representar, en una sola imagen, un conjunto infinito de situaciones, como la ejemplificada en el Gráfico 4.8.
Fuente: adaptado de <https://www.shutterstock.com/es/image-vector/boyle-mariotte-law-313511729>.
Otra ley de los gases, conocida como la Ley de Charles y Gay-Lussac, describe lo que ocurre con el volumen de un gas si se varía su temperatura mientras su presión y la cantidad de gas se mantienen constantes. En tales circunstancias se observa que los cambios de volumen son proporcionales a los cambios de temperatura. El Gráfico 4.10 muestra estas variaciones y cada una de las rectas representadas se corresponde con un valor alternativo de presión constante a la que se mantuvo el gas mientras se variaba su temperatura.
Fuente: adaptado de <https://byjus.com/chemistry/charless-law-relationship-between-temperature-volume/>.
La parte coloreada de las rectas del Gráfico 4.10 corresponde a valores efectivamente medidos del volumen a diferentes temperaturas. Por otra parte, los valores representados con una línea punteada no son valores medidos sino que son los valores que el volumen “debería” tener si siguiera siendo válida la recta observada a temperaturas más altas. Cuando asumimos que el comportamiento registrado en determinadas condiciones es válido en condiciones diferentes a las que se utilizaron para hacer el registro, estamos haciendo una extrapolación. En el caso del Gráfico 4.10, las rectas representadas como líneas punteadas corresponden a un comportamiento extrapolado. Ahora bien, es muy importante observar que todas las rectas extrapoladas alcanzan un volumen igual a cero a la misma temperatura. La temperatura a la que el volumen se hace cero es -273,15 °C. Dicha temperatura se conoce como cero absoluto y es la mínima temperatura que puede registrarse.
Las líneas rectas del Gráfico 4.10 describen el comportamiento de un gas ideal. Como allí se muestra, en el cero absoluto, el volumen de un gas ideal es cero. Los gases reales no siempre se comportan como el gas ideal. Por el contrario, en determinadas circunstancias ambos comportamientos difieren de modo notable. Esto ocurre, por ejemplo, cuando la temperatura del gas es muy baja. En tales situaciones, las fuerzas de atracción entre partículas se vuelven importantes en comparación con su energía de movimiento y por lo tanto la sustancia condensa. En otras palabras, el comportamiento indicado en el Gráfico 4.11 se aplica a los gases reales a temperaturas moderadas o altas, pero no a temperaturas muy bajas.
La escala Kelvin
En nuestro país es habitual medir la temperatura en la escala Celsius (también llamada centígrada). Así solemos decir que la temperatura es, por ejemplo, 10 °C, lo que puede leerse como diez grados centígrados o diez grados Celsius.
El cero de la escala Celsius corresponde a la temperatura de fusión normal del hielo, mientras que al punto de ebullición normal del agua se le asigna un valor de 100 °C. Estos son los llamados puntos fijos de la escala Celsius que determinan el valor de un grado centígrado como la centésima parte del rango de temperatura que va desde el punto de fusión normal del agua hasta su punto de ebullición normal.
La escala absoluta de temperatura, también llamada escala Kelvin, tiene intervalos de temperatura iguales a los de la escala centígrada, pero tiene corrido el cero. En particular, el punto de fusión del agua corresponde a 273,15 kelvin (se escribe 273,15 K) y el punto de ebullición normal del agua corresponde a 373,15 K. Por tanto, pasar de la escala centígrada a la Kelvin es sencillo, simplemente hay que sumar 273,15 al valor de la temperatura en grados centígrados.
T(K) = T(°C) + 273,15.(4.2)
Anteriormente se mencionó que la temperatura más baja alcanzable es -273,15 °C. De acuerdo con la ecuación recién mostrada, dicho punto corresponde a 0 K. Por lo tanto, en la escala Kelvin no son posibles los valores negativos de temperatura. A pesar de que la presentación de esta escala puede parecer anecdótica, es importante tener en cuenta que la escala Kelvin tiene un rol fundamental en muchas ramas de la ciencia, en general, y en la descripción del comportamiento de los gases ideales, en particular.
La Ley de Charles y Gay-Lussac se puede enunciar de una forma muy sencilla si la temperatura se mide en la escala Kelvin: a presión constante el volumen de un gas es directamente proporcional a su temperatura absoluta.
Fuente: adaptado de <https://www.aplusphysics.com/courses/honors/thermo/temperature.html>.
Una tercera ley muy importante para describir el comportamiento de los gases es la Ley de Avogadro. Establece que diferentes gases, si ocupan el mismo volumen y tienen las mismas presión y temperatura, entonces tienen también el mismo número de moléculas.
Ley de Avogadro: volúmenes iguales de gases diferentes, medidos en iguales condiciones de presión y temperatura, contienen igual número de partículas.
Las tres leyes de los gases que hemos visto hasta ahora pueden resumirse en una única ecuación, llamada ecuación general de los gases ideales. Establece que, si multiplicamos la presión del gas por su volumen y lo dividimos por el producto obtenido al multiplicar la temperatura absoluta por el número de moles (ver Unidad 2), el resultado debe ser una constante. Dicha constante se representa con la letra R y se llama constante de los gases. Matemáticamente, la ecuación general de los gases ideales se representa como:
\(\frac{P\times v}{n\times T}=R\)(4.3)
donde n es el número de moles. El valor adoptado por la constante R depende de las unidades que se utilicen para medir presión y volumen. En donde no puede haber ambigüedades es en la temperatura, que siempre debe ser expresada en Kelvin.
Actividades
- Sobre la base de los datos contenidos en la siguiente
tabla, indique cuál de las sustancias listadas se funde y cuál sublima
en las condiciones normales de la superficie terrestre.
Sustancia
Temperatura del punto triple
Presión del punto triple
Acetileno
-80,7 °C
1,2 atm
Amoníaco
-77,8 °C
0,06 atm
Arsénico
820 °C
35,8 atm
Zinc
420 °C
0,006 atm
- Indique si las siguientes afirmaciones son verdaderas
o falsas. En caso de que la afirmación sea falsa, realice los mínimos cambios
necesarios para volverla verdadera.
- El cambio de fase directo de sólido a gas se llama sublimación.
- La ropa recién lavada y tendida se seca porque el agua entra en ebullición.
- Cuando se entrega calor a un sólido en su punto de fusión la temperatura permanece constante hasta que todo el sólido se ha transformado en líquido.
- Los líquidos no tienen forma ni volumen propio.
- Si se duplica la presión de un gas mantenido en un recipiente cerrado a temperatura constante, ¿qué ocurre con el volumen del gas?
- Si se calienta un gas mantenido en un recipiente de volumen constante, ¿su presión aumenta o disminuye?
- ¿A cuántos grados Celsius equivalen 298 kelvin? El punto de ebullición del amoníaco es de -33,34 °C. Exprese el punto de ebullición del amoníaco en kelvin.
- Dos muestras de gas están contenidas en recipientes cerrados de igual volumen y tienen la misma temperatura. Si la presión de la muestra A es el triple que la presión de la muestra B, ¿cuál es la relación del número de partículas que hay en cada recipiente?